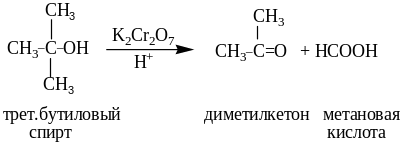- •Спирты. Фенолы.
- •Номенклатура спиртов
- •Способы получения спиртов
- •Восстановление карбонильных соединений.
- •5. Восстановление кислот и сложных эфиров.
- •Способы получения фенолов
- •3. Гидролиз водных растворов ароматических диазосоединений.
- •Физические свойства спиртов и фенолов. Особенности их строения.
- •Сравнение кислотно-основных свойств спиртов и фенолов
- •Химические свойства
- •Химические свойства спиртов
- •2. Реакция с металлоорганическими соединениями
- •3. Реакция этерификации – образование сложных эфиров
- •4. Реакция с галогеноводородами
- •5.Реакции с галогенидами фосфора и серы
- •6. Кислотная дегидратация спиртов
- •6.1. Образование простых эфиров
- •6.2.Образование алкенов
- •7. Окисление спиртов
- •Химические свойства фенолов
- •2.1. Образование простых алкилариловых эфиров
- •2.2.Образование простых диариловых эфиров
4. Реакция с галогеноводородами


Реакционная способность галогеноводородов в реакциях со спиртами уменьшается в ряду:
HJ > HBr > HCl
Метанол и большинство пространственно незатрудненных первичных спиртов реагирует с галогеноводородами по механизму SN2.
![]()
Механизм реакции может быть описан схемой:

Реакции, как правило, не сопровождаются перегруппировками.
Вторичные и третичные спирты реагируют с галогеноводородами
по механизму SN1.

Механизм
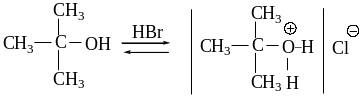

Диссоциация алкилгидроксониевого иона с образованием карб-
катиона и воды является стадией, лимитирующей скорость всей реакции.

Реакции спиртов, протекающие по SN1, могут сопровождаться перегруп-
пировкой образующегося карбкатиона и реакцией элиминирования.

5.Реакции с галогенидами фосфора и серы
![]()

Эти реакции протекают без побочных продуктов, быстро и с высоким выходом.
6. Кислотная дегидратация спиртов
В зависимости от температуры и соотношения спирта и Н2SO4 (2:1 или 1:1) могут проходить межмолекулярная дегидратация с образованием простых эфиров или внутримолекулярная дегидратация с получением алкенов.

6.1. Образование простых эфиров

Реакция образования простого эфира протекает по механизму SN, в которой протонированная молекула спирта выступает в качестве субстрата, а вторая молекула спирта – в роли нуклеофила.
В зависимости от строения спирта реакция может протекать по механизму SN2 (первичные спирты) или SN1 (вторичные и третичные спирты).
Пример 1
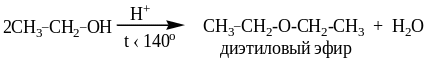
Механизм SN2
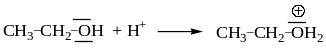

Первичные спирты при дегидратации, обычно, не перегруппировываются.

Пример2

Механизм SN1

I стадия

II стадия

6.2.Образование алкенов
Реакционная способность спиртов в реакции дегидратации определяется образованием более устойчивого карбокатиона и изменяется в следующем порядке:
первичные < вторичные < третичные < бензильный
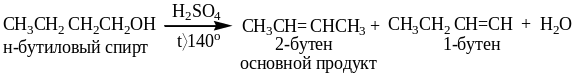

Вторичные, третичные и, по-видимому, первичные спирты подвергаются кислотной дегидратации (реакция элиминирования) по механизму Е1. Этим спирты отличаются от алкилгалогенидов, для которых характерны механизмы Е2 (в основном) и Е1.

Отщепление протона Н+ проходит в основном в соответствии с правилом Зайцева: водород отщепляется от менее гидрогенизированного атома углерода, соседнего с углеродом, несущим OH- группу. Эта реакция сопровождается образованием побочных продуктов - простых и сложных эфиров, а также, если позволяет углеродный скелет молекулы, и продуктов перегруппировок.
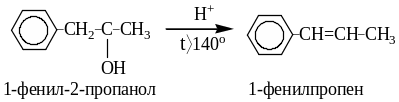

7. Окисление спиртов
Спирты окисляются кислородом воздуха в присутствии медных и других катализаторов при t=300-500oC(K2Cr2O7/H2SO4;CrO3/пиридин; KMnO4/H+; MnO2 и др.), а также дегидрируются при 100-300 oC над Cu, Ag, Ni, Pt и др.
Независимо от выбранных условий первичные спирты окисляются до альдегидов, вторичные до кетонов. Альдегиды далее окисляются до кислот без изменения числа атомов углерода, а кетоны с разрывом С-С связей до смеси кислот. Третичные спирты окисляются в жестких условиях с разрывом углеродной цепи с образованием смеси кетонов и кислот.

Примеры