
- •Спирты. Фенолы.
- •Номенклатура спиртов
- •Способы получения спиртов
- •Восстановление карбонильных соединений.
- •5. Восстановление кислот и сложных эфиров.
- •Способы получения фенолов
- •3. Гидролиз водных растворов ароматических диазосоединений.
- •Физические свойства спиртов и фенолов. Особенности их строения.
- •Сравнение кислотно-основных свойств спиртов и фенолов
- •Химические свойства
- •Химические свойства спиртов
- •2. Реакция с металлоорганическими соединениями
- •3. Реакция этерификации – образование сложных эфиров
- •4. Реакция с галогеноводородами
- •5.Реакции с галогенидами фосфора и серы
- •6. Кислотная дегидратация спиртов
- •6.1. Образование простых эфиров
- •6.2.Образование алкенов
- •7. Окисление спиртов
- •Химические свойства фенолов
- •2.1. Образование простых алкилариловых эфиров
- •2.2.Образование простых диариловых эфиров
Сравнение кислотно-основных свойств спиртов и фенолов
Спирты не обладают ярко выраженными кислотными или основными свойствами и являются практически нейтральными соединениями, в незначительной степени проявляющими амфотерные свойства.
![]()
Электронодонорная алкильная группа повышает отрицательный заряд на атоме кислорода и диссоциация ОН-связи проходит в меньшей степени чем в молекуле воды (для спиртов рКа ≈18, для воды рКа =15,7).
Поэтому спирты (проявляя очень слабые кислые свойства) реагируют только со щелочными и активными металлами и не реагируют со щелочами.

Алкоголяты являются сильными основаниями и сильными нуклеофильны-ми реагентами. Кислотные свойства спиртов убывают в следующем порядке:
первичные > вторичные >третичные.
Спирты (как и вода) проявляют и основные свойства. Они реагируют на холоду с сильными кислотами, образуя соли алкилоксония (которые превращаются в галогенопроизводные).

Основные свойства спиртов убывают в противоположном порядке по сравнению с кислотными.
Фенолы проявляют значительно большую кислотность, чем спирты или вода, однако, как кислоты, они слабее, чем угольная и карбоновые кислоты.
Увеличение кислых свойств фенолов связано с положительным мезомерным эфекфтом (+М), в результате которого в ароматическое кольцо смещается электронная плотность от кислорода, что в свою очередь, еще больше способствует поляризации ОН-группы.

Образование фенолят аниона выгоднее, чем алкоголят-аниона, так как происходит образование устойчивого стабилизированного резонансом аниона.

Резонансные структуры фенолят аниона.
Фенол (рКа=10) на 8 порядков обладает более кислыми свойствами, чем циклогексанол (рКа=18). Фенол в отличие от спиртов реагирует не только со щелочными металлами, но и со щелочами с образованием солей - фенолятов.

Из данных Таблицы 2 видно, что введение в ароматическое ядро фенола электронодонорных заместителей уменьшает кислотность, а введение
электроноакцепторных увеличивает.
Химические свойства
Спирты и фенолы по природе своей функциональной группы относятся к числу нуклеофильных реагентов, причем спирты являются более сильными нуклеофилами, чем фенолы.
В общем виде для соединений типа R-OH возможно прохождение реакций как
![]()
Химические свойства спиртов
![]()
1. Спирты (как кислоты) реагируют с активными и щелочными металла- ми (Na, K, Mg, Al и др.)


2. Реакция с металлоорганическими соединениями
![]()
3. Реакция этерификации – образование сложных эфиров
Спирты взаимодействуют с минеральными и органическими кислотами с образованием сложных эфиров и воды:

Процесс этерификации катализируется как кислотами, так и основаниями. Механизм кислотного катализа заключается в протонировании кислорода карбоксильной группы, что приводит к увеличению электронного дефицита на атоме углерода карбоксильной группы и ускорению атаки молекулой спирта – нуклеофильным реагентом.


Механизм основного катализа заключается в повышении нуклеофильности молекулы спирта по обменной реакции:
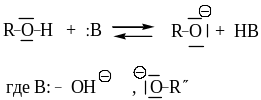

Реакционная способность спиртов в реакции этерификации уменьшается в ряду:
первичные > вторичные > третичные
Такое изменение реакционной способности объясняется пространственными факторами.
Спирты легко реагируют с сильными ацилирующими реагентами – хлорангидридами и ангидридами кислот с образованием сложных эфиров:


![]()
Реакции нуклеофильного замещения гидроксила в спиртах катализируются кислотами с образованием оксониевого катиона.
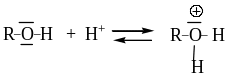
В зависимости от строения спирта и условий проведения синтеза возможно прохождение конкурирующих реакций нуклеофильного замещения (SN) и элиминирования (Е), как это показано на схеме:

