
- •Спирты. Фенолы.
- •Номенклатура спиртов
- •Способы получения спиртов
- •Восстановление карбонильных соединений.
- •5. Восстановление кислот и сложных эфиров.
- •Способы получения фенолов
- •3. Гидролиз водных растворов ароматических диазосоединений.
- •Физические свойства спиртов и фенолов. Особенности их строения.
- •Сравнение кислотно-основных свойств спиртов и фенолов
- •Химические свойства
- •Химические свойства спиртов
- •2. Реакция с металлоорганическими соединениями
- •3. Реакция этерификации – образование сложных эфиров
- •4. Реакция с галогеноводородами
- •5.Реакции с галогенидами фосфора и серы
- •6. Кислотная дегидратация спиртов
- •6.1. Образование простых эфиров
- •6.2.Образование алкенов
- •7. Окисление спиртов
- •Химические свойства фенолов
- •2.1. Образование простых алкилариловых эфиров
- •2.2.Образование простых диариловых эфиров
2.3.3 Гидроксипроизводные углеводородов
Гидроксипроизводные со связью С(sp3)-OH. Одноатомные спирты. Номенклатура. Изомерия. Получение спиртов гидролизом галогеналканов, гидратацией алкенов, восстановлением альдегидов и кетонов, взаимодействием магнийорганических соединений с альдегидами, кетонами, окисью этилена. Водородная связь, ее влияние на физические свойства. Химические свойства. Кислотные свойства. Константа кислотности. Алкоголяты, их свойства. Основные свойства спиртов. Соли оксония. Образование сложных эфиров (реакция этерификации), дегидратация (получение алкенов и простых эфиров). Реакция нуклеофильного замещения гидроксильной группы на галоген с использованием галогеноводородов, галогенидов фосфора и хлористого тионила. Окисление спиртов. Отдельные представители: метанол, этанол, изопропанол, двухатомный спирт этиленгликоль, трехатомный спирт глицерин (получение, использование). Техника безопасности при работе с метиловым и этиловым спиртами, этиленгликолем.
Гидроксипроизводные со связью С(sp2)-OH. Фенолы. Методы получения фенолов: из солей сульфокислот, галогенопроизводных, из кумола и ароматических аминов. Физические свойства фенолов. Химические свойства. Кислотность. Влияние, оказываемое на кислотные свойства о- и п-заместителями. Образование фенолятов. Реакции алкилирования и ацилирования фенолов. Особенности реакций электрофильного замещения водорода ядра у фенолов (галогенирование, нитрование, сульфирование). Гидрирование и окисление фенолов. Конденсация фенолов с альдегидами. Фенолформальдегидные смолы. Фенол, пикриновая кислота (получение и применение). Техника безопасности при работе с фенолами.
Спирты. Фенолы.
Для соединений общей формулы R-OH характерно наличие одной или нескольких гидроксильных групп –ОН, связанных с углеводородным радикалом. В зависимости от того в каком гибридном состоянии находится атом углерода, связанный с –ОН группой различают:
СSР3 – OH – спирты

СSР - OH – не существует
Спирты, в зависимости от числа –ОН групп в молекуле, подразделяются на одно-, двух-, трех- и многоатомные, например:



Одноатомные спирты в зависимости от природы радикала R могут быть алифатические, циклические, ароматические, насыщенные и ненасыщенные.
Спирты также подразделяются на первичные, вторичные и третичные:

Примеры.
Первичные спирты:

Вторичные спирты:

Третичные спирты:

Фенолы – это производные аренов, в которых один или несколько атомов водорода ароматического кольца замещены на гидроксильные группы, т.е. связаны с углеродом в sp2 гибридном состоянии.
Примеры



Номенклатура спиртов
Для названий спиртов используются три номенклатуры.
Тривиальная – название состоит из названия алкильной части и слова спирт.
Карбинольная (рациональная) – спирты рассматриваются как производные метилового спирта - карбинола (СН3ОН).
Систематическая (IUPAC) – к названию углеводорода самой длинной углеродной цепи, содержащей ОН-группу, добавляется суффикс –ол. Цепь при этом нумеруют с того края, к которому ближе ОН-группа.
Примеры:


В полифункциональных соединениях при наличии функциональных групп старше гидроксильной, последняя обозначается приставкой окси- или гидрокси-.
Способы получения спиртов
Существует много различных способов получения спиртов наиболее важные из которых приведены ниже.
1. Кислотная гидратация алкенов позволяет получить этанол, вторичные и третичные спирты, но лишь те, которые образуются в соответствии с правилом Марковникова.



Механизм реакции электрофильного присоединения (АdE ) следующий

К карбкатиону может присоединиться как вода, так и анион серной кислоты с образованием алкилсерной кислоты, гидролиз которой также приводит к спирту.

Гидратацию алкенов можно также проводить в присутствии гетерогенного катализатора, например Al2O3.
2. Гидролиз галогенопроизводных углеводородов позволяет получать первичные, вторичные и третичные спирты. Реакция может протекать как по механизму нуклеофильного замещения SN1, так и по SN2.

3. Mg-органический синтез.
Карбонильные соединения с реактивом Гриньяра (магнийгалогеналкил) позволяют получить первичные, вторичные и третичные спирты. При взаимодействии формальдегида с реактивом Гриньяра получают первичные спирты.
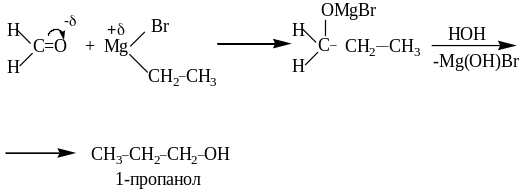
Альдегиды с реактивом Гриньяра дают вторичные спирты.


Взаимодействие кетонов с реактивом Гриньяра приводит к третичным спиртам.


