
- •1)Развитие представлений о строении атома.
- •2)Двойственная природа электрона. Квантовые числа
- •Квантовые числа
- •3)Принципы заполнения орбиталей
- •4)Химическая связь: виды, причины образования, основные характеристики
- •5)Ковалентная химическая связь. Мвс. Свойства ковалентной связи.
- •6)Ковалентная связь. Ммо
- •Сравнительная характеристика ммо и мвс
- •7)Ионная связь. Металлическая связь. Донорно-акцепторная связь.
- •8)Водородная связь. Межмолекулярные взаимодействия.
- •9)Агрегатные состояния вещества.
- •10)Кристаллические вещества.
- •11) Классификация кристаллов по типу связей. Жидкие кристаллы.
- •12)Атомные нарушения структуры кристалла.
- •13)Термодинамическме системы и параметры. Основные понятия.
- •14)Первое начало термодинамики.
- •15)Термохимия. Тепловой эффект. Закон Гесса и следствия из него.
- •16) Второе начало термодинамики. Энтропия.
- •17)Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18)Обратимые и необратимые химические реакции. Константа химического равновесия.
- •19)Химическое равновесие. Принцип Ле-Шателье.
- •2)Влияние давления.
- •3)Влияние температуры.
- •20)Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •16) Второе начало термодинамики. Энтропия.
- •17)Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18)Обратимые и необратимые химические реакции. Константа химического равновесия.
- •19)Химическое равновесие. Принцип Ле-Шателье.
- •2)Влияние давления.
- •3)Влияние температуры.
- •20)Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •16) Второе начало термодинамики. Энтропия.
- •17)Энергия Гиббса, Гельмгольца. Критерии направленности химических процессов.
- •18)Обратимые и необратимые химические реакции. Константа химического равновесия.
- •19)Химическое равновесие. Принцип Ле-Шателье.
- •2)Влияние давления.
- •3)Влияние температуры.
- •20)Химическая кинетика. Основные понятия. Закон действующих масс. Молекулярность и порядок реакции.
- •Скорость гомогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени в единице объема.
- •Cкорость гетерогенной реакции - количество вещества, вступившего в реакцию или образующегося в результате реакции за единицу времени на единице поверхности.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозион. Среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая). Классификация коррозионных процессов:По условиям протекания.
- •Подвод реагентов к электроду;
- •Э/х реакция, которая включает в себя и химические реакции;
- •Отвод продуктов реакции от электрода.
- •48. Коррозия металлов. Классификация коррозионных процессов.
- •Подвод коррозион. Среды или отдельных ее компонентов к поверхности металла.
- •Взаимодействие среды с металлом.
- •Полный или частичный отвод продуктов от поверхности металла (в объем жидкости, если среда жидкая). Классификация коррозионных процессов:По условиям протекания.
1)Развитие представлений о строении атома.
Капельная модель (пудинг Томсона). В 1902 У.Томсон высказывает предположение, что атом – сгусток материи, внутри которой равномерно распределены электроны. 1904 Д.Томсон дорабатол, тогда же он впервые предположил, заряж. частицы распределены по орбитам и что количество электронов равно половине атомной массы.
Планетарная (ядерная) модель
Резерфорд брал метал. золот. Пластинку, пропуская через нее α-лучи. Часть лучей проходили спокойно, а 1 из 20 тыс. возвращался назад.
В 1911 году на основании вышесказанного были сделаны следующие выводы:
В атоме есть некое препятствие (ядро). Ядро имеет положительный заряд, имеет малые размеры относительно размеров самого атома, масса ядра больше массы α-частицы, вокруг ядра по круговым орбитам вращаются электроны, число которых равно заряду ядра, сила электростатического притяжения между ядром и электронами уравновешена центростремительной силой так, что электроны удерживаются на орбитах, а не падают на ядро. Диаметр ядра
 .
диаметр атома
.
диаметр атома  .
.
Недостатки теории Резерфорда: Несовместимость с законами классической физики. Если электроны движутся вокруг ядра, то их движение ускоренное, и, следовательно они должны были бы терять энергию и падать на ядро. Непрерывное изменение траектории электронов должно способствовать непрерывному изменению частоты излучения.
Модель Нильса-Бора
1913 г. Квант. теория Планка и теория Резерфорда помогли Нильсу сделать выводы: е может вращаться не по люб. орбитам а по орбитам с опр. радиусом, отвечающим возможному значению энегргии атома. Энергия, выделяемая или поглощаемая при переходе электрона с одной орбиты на другую, равна разности между количеством энергии в основном состояние и возбужденном состояниях.
Недостатки теории Бора: Справедлива только для атома Н и не может объяснить строение сложных атомов. Теория представляла электрон как частицу, обладающую только корпускулярными свойствами. Теория внутренне не логична, так как, с одной стороны, она опирается на теорию классической механики, а с другой стороны, привлекает квантовую теорию. Теория не могла объяснить связь между атомами в молекулах.
Современные представления об атоме:
1897- Томсон доказал наличие е. 1917 –Ми льен измерил заряд е. 1911-Резерфорд открыл протон, 1932- Чедрик нейтрон. Заряд ядра = порядковому номеру элемента. Число нейтронов = A-Z.
2)Двойственная природа электрона. Квантовые числа
Двойственность свойств электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определённую массу покоя), а с другой — его движение напоминает волну и может быть описано определённой амплитудой, длиной волны, частотой колебаний и др. Поэтому нельзя говорить о какой-либо определённой траектории движения электрона — можно лишь судить о той или иной степени вероятности его нахождения в данной точке пространства (Принцип неопределенности Гейзенберга)
Уравнение
Шрёдингера:
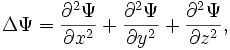 Орбиталь- это область пространства, в
которой наиболее вероятно прибывание
е.
Орбиталь- это область пространства, в
которой наиболее вероятно прибывание
е.
