
- •1. Объяснить какие превращения в металле относятся к фазовым переходам первого и второго рода. Привести примеры.
- •2. Как изменяется объем, межатомные связи, компактность упаковки атомов при плавлении различных металлов?
- •3. Что означают понятия ближний и дальний порядок в расположении атомов? Каким фазовым состояниям присущ ближний и дальний порядок?
- •4. Показать, что является термодинамическим стимулам крист-ии металла? Почему для начала крист-ии металлов необходимо переохлаждение?
- •5. Записать общее изменение энергии Гиббса при кристаллизации металлов. Из чего складывается объемная и поверхностная межфазная энергия?
- •6. Почему для реализации гомогенной кристаллизации необходимы более значительные степени переохлаждения, чем для гетерогенной крист-ии?
- •7. Где образуются зародыши твердой фазы при гомогенной и гетерогенной крист0ии металла? Почему термодинамически выгодно образования кристаллов на готовых центрах?
- •8. Как зависит общее изменение энергии Гиббса от размера кристалла при затвердевании? Какой размер зародыша кристалла наз-ся критическим?
- •9. Почему с увеличением степени переохл-ия при крист-ии размер критического зародыша уменьшается?
- •10. Доказать почему размер кристалла меньше размера критического растворяется в жидкости?
- •11. Изобразить кривые охл-ия металла при разных степенях переохл-ия/
- •12. Как зависят от δт скорость образования центров кристаллизации n, и линейная скорость роста кристаллов с при затвердевании металлов?
- •13. Каково строение межфазной границы раздела жидкость-кристалл у Cu и Bi?
- •14. Описать нормальный механизм роста кристаллов Al при их крист-ии?
- •15. Описать ступенчатый механизм роста Sb при крист-ии?
- •16. Какие формы роста при затвердевании принимают кристаллы металлов? Описать условия роста дендритной формы кристаллов.
- •17. Изобразить структуру металла после равновесной гетерогенной крист-ии. В каких условиях возможно равновесное затвердевание?
- •18. Какие факторы опр-ют макроструктуру слитка? Описать их влияние.
- •19. В каких условиях должен кристаллизоваться чистый металл, чтобы получить мелкозернистую структуру?
- •20. С какой целью проводят модифицирование металлов и сплавов? Привести примеры модификаторов.
- •21. Какие виды пористости возникают при затвердевании металлов и сплавов? Как влияет величина интервала крист-ии на объем рассеянной пористости металлов и сплавов?
- •22. От чего зависит склонность к образования горячих трещин при литье сплавов?
- •23. Как образуются твердые растворы внедрения и замещения? Приведите пример систем ком-ов.
- •24. Какие условия должны выполняться при образовании неограниченных твердых растворов замещения?
- •25. Как располагаются атомы в неупорядоченных и упорядоченных твердых растворах? Какими св-ми обладают упорядоченные твердые растворы?
- •26. В чем отличие промежуточных фаз от образующих их ком-ов и от твердых растворов? Какие формы кристаллов хар-ны для промежуточных фаз.
- •27. Доказать почему крист-ия чистых металлов относится к нонвариантным превращениям, а крист-ия твердых растворов – к моновариантным превращениям?
- •28. Какие диффузионные процессы должны реализоваться при равновесной крист-ии твердых растворов?
- •29. Как изменяется солидус диаграммы с непрерывным рядом твердых растворов в условиях быстрого охл-ия? Изобразить солидус в системе Сu-Ni.
- •30. Пояснить явление дендритной ликвации при крист-ии твердых растворов?
- •31. В чем отличие равновесной и неравновесной структуры сплавов типа твердого раствора? Изобразить структуру на примере сплавов системы Сu-Ni или Сu-Zn.
- •32. Объяснить, как условия ускоренного охл-ия влияют на полноту прохождения различных диффузионных процессов при крист-ии?
- •33. Какую структурную составляющую наз-ют эвтектикой? Приведите примеры регулярной и нерегулярной эвтектики на примере реальных сплавов.
- •3 4. Почему в системах эвтектического типа при ускоренном охл-ии точка максимальной растворимости ком-та в твердом растворе сдвигается влево?
- •35. Какое влияние неравновесная крист-ия оказывает на литую структуру сплавов эвтектической система?
- •36 Что такое квазиэвтектика? в каких сплавах образуется такая структура?
- •37. Какую структуру наз-ют вырожденной эвтектикой и какие условия способствуют ее образованию?
- •43. Почему при значительных степенях переохл-ия полиморфное превращение Fe протекает по сдвиговому мартенситному механизму? Описать, как смещаются атомы при фазовых превращениях?
- •44. Изобразите структуру Сu после холодной деформации. Чем отличается текстура деформации от волокнистой структуры металлов и сплавов?
- •45. Как изменяется структура деформированного металла при нагревах после деформации? Изобразите структуру Ni после холодной деформации и рекристаллизационного отжига.
- •5. Объяснить, почему для развития перитектического превращ-ия в системе Fe – Fe3c необходимо переохл.?
- •6. Описать, по каким вариантам может идти перитектическая крист-ия в системе Fe – Fe3c.
- •7. Изобразите схему перитектического крист-ии с переносом в-ва через слой а.
- •8. При зарождении а на границах ф в результате перитектического превращ-ия, указать в условиях переохл. Равновесные конценр-ии углерода в а на межфазных границах а-жидкость и а-ф.
- •13. Указать, в какой фазе при перитектической крист-ии устанавливается градиент конц-ии по с, вызывающий протекание выравнивающей дифф-ии по одноуму и другому варианту. Описать формирование структуры.
- •14. Объяснить, что является термодинамическим стимулом эвтектической крист-ии в системе Fe – Fe3c.
- •15. Доказать, что в условиях переохл. При эвтектической крист-ии ледебурита жидкость пересыщена как Fe, так и с.
- •16. Доказать, почему при эвтектической крист-ии в системе Fe – Fe3c возможно одновременное выделение а и ц.
- •17. Указать, какая фаза является ведущей в реальных условиях крист-ии л и а-графитовой эвтектики.
- •18. Как растет эвтектическая колония при малых степенях переохл.?
- •19. Описать образование и рост зародыша эвтектической колонии пластинчатого л.
- •24. Какие дифф-ые процессы должны протекать при эвтектической крист-ии л?
- •25. На что влияет увеличение степени переохл-ия при крист-ии эвтектического л?
- •27. Записать эвтектическое превращ-ие по стабильной и метастабильной диаграмме Fe – c. Изобразить структуру аустенитно-графитовой эвтектики.
- •28. Как влияет степень переохл-ия и модифицирование на форму и размеры графита в а-графитовой эвтектике.
- •29. Какие примеси способствуют и препятствуют образованию графита при крист-ии?
- •30. Указать, в какой форме присутствует первичный, вторичный и третичный ц в сталях и белых чугунах. Приведите примеры.
1. Объяснить какие превращения в металле относятся к фазовым переходам первого и второго рода. Привести примеры.
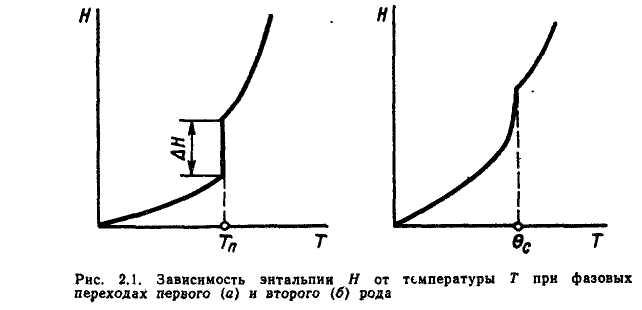
В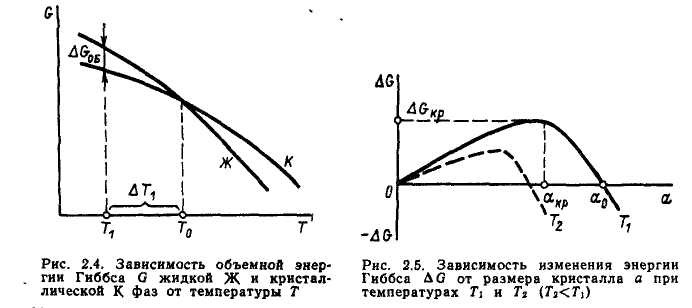 чистых металлах при фазовых
переходах I
рода
энтальпия
(теплосодержание)
Н
и
удельный объем изменяются скачками при
температуре перехода Тп.
Разницу в энтальпии двух
фаз АН
при
t-ре
перехода наз-ют теплотой фазового
превращения. К фазовым переходам I
рода в металлах
относятся плавление, кристаллизация и
полиморфные превращения.
чистых металлах при фазовых
переходах I
рода
энтальпия
(теплосодержание)
Н
и
удельный объем изменяются скачками при
температуре перехода Тп.
Разницу в энтальпии двух
фаз АН
при
t-ре
перехода наз-ют теплотой фазового
превращения. К фазовым переходам I
рода в металлах
относятся плавление, кристаллизация и
полиморфные превращения.
При фазовых переходах II рода скачкообразного изменения энтальпии и удельного объема в точке перехода не наблюдается. К фазовым переходам II рода в металлах относится магнитное превращение: переход при нагревании из ферромагнитного состояния в парамагнитное и обратный переход при охл-ии.
Т-ру перехода в этом случае наз-ют точкой Кюри QС.
2. Как изменяется объем, межатомные связи, компактность упаковки атомов при плавлении различных металлов?
При плавлении металлов возрастает энергия колебательного движения атомов и повышается концентрация вакансий и межузельных атомов. При опр-ой t-ре исчезает кристаллическая решетка. Некоторая время теплота затрачивается на разрыв межатомных связей в кристалле и t-ра не повышается. Это t-ра Т0 (площадка на диаграмме нагрева). Металлическая связь не обладающая направленностью, обуславливает стремление к плотной упаковке атомов в жидком металле. При плавлении объем металла увеличивается не более чем на 6%. Компактность упаковки атомов уменьшается.
3. Что означают понятия ближний и дальний порядок в расположении атомов? Каким фазовым состояниям присущ ближний и дальний порядок?
Жидкий металл в отличии от кристаллического не имеет дальний порядок, который характеризируется периодическим расположением атомов по узлам кристаллической решетки. В расплаве ближний порядок – упорядоченное расположение атомов вокруг произвольно выбранного атома на расстояниях, соизмеримых с межатомными. Его хар-ки – кратчайшее межатомное расстояние и среднее число ближайших соседей (координационное число).
4. Показать, что является термодинамическим стимулам крист-ии металла? Почему для начала крист-ии металлов необходимо переохлаждение?
Чтобы началась крист-ия необходимо переохладить расплав ниже Т0. Разность ∆Gоб является термодинамическим стимулом (движущей силой) кристаллизации. Чем больше степень переохлаждения, тем больше ∆Gоб.
5. Записать общее изменение энергии Гиббса при кристаллизации металлов. Из чего складывается объемная и поверхностная межфазная энергия?
Образование в расплаве кристалла объемом V приводит к снижению энергии Гиббса на величину ΔGоб = VΔgo6, где Δgo6 – изменение энергии Гиббса, приходящееся на единицу объема твердой фазы. Наряду с этим из-за возникновения поверхности раздела кристалл-расплав энергия Гиббса должна возрасти на величину
ΔGПВ =F∙y, где F – площадь указанной поверхности, а у – межфазная энергия Гиббса единицы поверхности. Таким образом, при образовании в расплаве кристалла результирующее изменение энергии Гиббса выразится алгебраической суммой:
ΔG =-ΔGоб + ΔGПОВ; ΔG=-ΔVgoб + Fу. (2.4)
G = U – TS + pV; U – внутренняя энергия; S – энтропия; V – объемная энергия; Т – t-ра; p – давление.
