
- •1) Равномерное вращение мат. Точки
- •2) Неравномерное вращение мат. Точки
- •2)Э/магнитное
- •4)Слабое (управляет распадом элементарных частиц на более лёгкие)
- •Сложение гармонических колебаний
- •Метод векторных диаграмм
- •15. Уравнение состояния идеального газа.
- •16.Эксперементальные газовые законы
- •18.Первое начало термодинамики:
- •Обратимые и необратимые процессы.
- •20. Методы решения задач по разделам «Механика» и «Молекулярная физика»
15. Уравнение состояния идеального газа.
Идеальный газ (ИГ) – теоретическая модель газа, в которой пренебрегают размерами и взаимодействиями частиц газа и учитывают лишь их упругие столкновения.
Уравнение состояния ИГ – это зависимость между параметрами ИГ –давление Р, объемом V и абсолютной температурой Т, определяющими его состояние:
РV=BT,
где В зависит от массы газа m и его молекулярной массы М. В таком виде уравнение получено учёным Клапейроном и носит его имя. Менделеев вывел уравнение состояния для 1 моля ИГ:
РV=RT,
где R – универсальная газовая постоянная. Если молярная масса газа М, то:
РV=mRT/M.
В этой форме уравнение носит название Клапейрона-Менделеева. Оно объединяет газовые законы Гей-Люсака, Бойля-Мариотта, Авогадро и Шарля.
Уравнение состояния может быть получено из зависимости давления от температуры Р=nkT, если в неё подставить концентрацию молекул n из выражения
n=N/V=mNaвогадро/VM,
где Nавогадро – постоянная Авогадро, а N – число молекул в теле. В результате получим:
PV=mkNавогадроT/M,
где kNавогадро=R – универсальная газовая постоянная, равная 8,31*10^-23 Дж/моль*К, k – постоянная Больцмана, равная 1,38*10^-23 Дж/К. Отношение уравнений при двух наборах параметров дает:
P1V1/T1=P2V2/T2=const (1,2 – индексы).
16.Эксперементальные газовые законы
Газовый закон – количественная зависимость между двумя параметрами газа при фиксированном значении третьего параметра. Газовые законы ИГ – частные случаи уравнения состояния ИГ
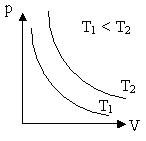
1.Закон Бойля – Мариотта (изотермические процессы)
Для данной массы произведение давления газа на его объём постоянно, если температура газа не меняется.
PV=const если Т=const
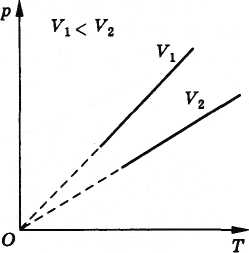
2. Закон Шарля (изохорические процессы)
Давление Р данной массы газа при постоянном объёме пропорционально температуре.
P/T=const при V=const
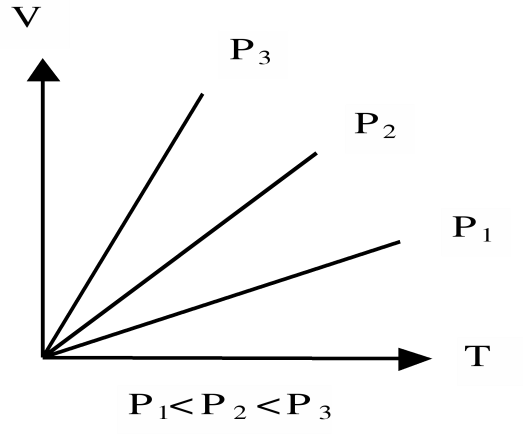
3. Закон Гей – Люссака (изобарические процессы)
При постоянном давлении Р объём V ИГ меняется линейно с температурой.
V/T=const при P=const
18.Первое начало термодинамики:
Внутренняя энергия U — энергия системы, включающая кинетическую энергию хаотичного (теплового) движения микрочастиц системы (молекул, атомов и т.д) и потенциальную энергию взаимодействия этих частиц друг с другом. U тел зависит от их температуры, количества молекул и объема.
U=3/2(υRT) где R=8.31 Дж/(К*моль) — универсальная газовая постоянная.
(Способы изменения внутренний энергии тел, при теплопередаче: 1) теплопроводность; 2) конвекция; 3) излучение;
в следствии механической работы ( деформации) : 1) изменение формы ( например, сгибание подковы); 2) изменение объема ( например, вспыхивание ваты при сжатии воздуха); 3) трение).
Теплопередача — это обмен энергией между рассматриваемой системой и внешними телами без совершения работы внешними силами или силами, действующими на внешние тела со стороны рассматриваемой системы.
Количество теплоты Q — это энергия, переданная от одного тела к другому при теплопередаче.
Удельная теплоемкость с — скалярная величина, численно равная количеству теплоты, которое получает или отдает вещество массой 1 кг при изменении его температуры на 1 К.
Удельная теплоемкость вещества:
c = Q/ (mΔT).
Молярная :
C=M*c.
CV–молярная теплоемкость в изохорном процессе (V=const) и Cp – молярная теплоемкость в изобарном процессе(p = const).
QV=CV ΔT=ΔU.
Qp =ΔU +p (V2 – V1) = CV ΔT+pΔV,
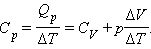
![]()
Т е:
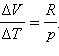
А тогда:
Cp = CV + R.
Q= cm(Tк-Тн) — количество теплоты, полученное телом массой m с удельной теплоемкостью с в ходе теплопередачи с изменением температуры тела от начальной Тн до конечной Тк.
Количество теплоты, выделяющееся или поглощающееся в каком-либо процессе, измеряется калориметром.
Работа в термодинамике — работа сил, приложенных к внешним телам со стороны рассматриваемой системы при ее деформации.
Работа газа положительная при расширении газа и отрицательна при его сжатии. В координатах p, V работа газа численно совпадает с площадью фигуры под графиком зависимости давления от объема.
Первое начало термодинамики утверждает, что внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме работ внешних и количества теплоты, переданного системе.
∆U= Aвнеш + Q
Если при нагревании газ расширяется и при этом совершает работу Аг (работа газа, против внешних сил), то первое начало термодинамики можно сформулировать по-другому:
Q=∆U+Aг — количество теплоты, переданное телу, расходуется на изменение его внутренней энергии и на работу, совершаемую газом против внешних сил.
Работа газа и внешних сил при медленной (равновесной) деформации газа равны по модулю и имеют противоположный знак:
Aвнеш = -Аг.
Q<0 если происходит передача энергии от системы внешним телам, поэтому нужно считать, что Q- модуль количества теплоты, значит + перед ней, если система получает энергию и - , если система отдает энергию при теплопередаче.
Изменение внутренней энергии определяется только ее начальным и конечным состоянием, а работа системы зависит от процесса деформации, то количество теплоты, полученное (отданное) газом зависит от характера процесса. Поэтому, например, теплоемкость газа в изохорном процессе всегда меньше его теплоемкости в изобарном процессе, так как при повышении температуры газа в обоих процессах на один градус его внутренняя энергия возрастает на одинаковое значение, но в изобарном процессе газ еще должен совершить работу против внешних сил, на что должно быть дополнительно израсходовано подводимое извне количество теплоты.
при изобарном процессе (∆p=0, p-const)
![]()
при изохорном процессе (A = 0, ∆U=0, U-const)
![]()
при изотермическом процессе (ΔU = 0, ∆T=0, T-const)
![]()
Здесь m масса газа, M—молярная масса газа, Cv—молярная теплоемкость при постоянном объёме, причём последнее равенство верно только для идеального газа.
Если система состоит из нескольких тел, между которыми есть теплообмен, а теплообменом с внешней средой можно пренебречь, то можно записать уравнение теплового баланса: количество теплоты, отданное одними телами системы, равно количеству теплоты, полученному другими телами системы от первых: Q получен. = Q отдан.
Идеальный газ:
Изобарный процесс:
p-const;
Q=∆U+Aг
Q=3/2(υR∆T)+p∆V =3/2(υR∆T)+υR∆T=5/2(υR∆T)
Изохорный процесс:
V-const;
A=0;
Q=∆U=3/2(υR∆T)=3/2V∆p;
Изотермический процесс:
T-const;
∆U=0;
Q=A=υRTLn(V2/V1)
Внутренняя энергия идеального газа(не зависит от объема и давления)
![]() .
.
ΔU = νCVΔT,
где ν — количество вещества, ΔT — изменение температуры.
Вн энергия неидеального газа :
![]()
![]() (входит в уравнение
адиабатического процесса)
(входит в уравнение
адиабатического процесса)
Итак:
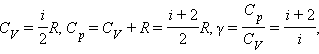
Адиабатический
процесс -
это такое изменение состояний газа, при
котором он не отдает и не поглощает
извне теплоты. Следовательно, адиабатический
процесс характеризуется отсутствием
теплообмена газа с окружающей средой.
Адиабатическими можно считать быстро
протекающие процессы. Так как передачи
теплоты при адиабатическом процессе
не происходит, то ![]() и
уравнение I начала термодинамики
принимает вид
и
уравнение I начала термодинамики
принимает вид
![]() .
.
Q=0, A=-∆U
одноатомный идеальный газ:
A=-∆U=-3/2(υR∆T)
Циклический процесс:
Работа газа численно равна площади фигуры, ограниченной диаграммой цикла в координатах p,V.
Изменение внутренней энергии при завершении цикла не происходит.
Количество теплоты, полученное газом за цикл ( при подводе энергии Q>0; при отводе энергии Q<0), равно работе, совершенной газом за цикл.
