
- •1 Атмосфера. Ее строение и состав.
- •2 Источники загрязнения атмосферы.
- •Экологические проблемы загрязнения атмосферы
- •4 Характеристика основных загрязняющих атмосферу веществ.
- •5 Характеристика основных металлов, загрязняющих атмосферу.
- •Валовые выбросы в атмосферу на территории рб.
- •7 Выбросы в атмосферу от стационарных источников.
- •8 Выбросы предприятий энергетического сектора.
- •Газовые выбросы предприятий химической и нефтехимической промышленности.
- •10.Выбросы предприятий машиностроительной промышленности и промышленности строительных материалов в рб
- •11 Выбросы предприятий деревообрабатывающей промышленности агропромышленного комплекса.
- •12 Мониторинг состояния атмосферного воздуха.
- •13. Характеристика природного топлива.
- •14. Характеристика искусственного топлива.
- •15 Альтернативное углеводородсодержащее топливо.
- •16 Экологические нормативы качества природной среды.
- •17 Санитарно-гигиенические качества атмосферного воздуха.
- •18 Токсичность веществ, эффекты суммации и потенцирования.
- •19. Интегральные показатели качества атмосферного воздуха.
- •20 Нормативы допустимых выбросов предприятий.
- •21 Принципы и задачи проведения экологической экспертизы.
- •22 Состав экологической экспертизы проекта.
- •23 Состав экологического паспорта предприятия.
- •24 Категория опасности предприятия
- •25 Санитарно-защитные зоны (ссз) предприятий.
- •26 Виды ущерба природной среде.
- •27 Экономический механизм природопользования.
- •28 Экономические инструменты охраны окружающей среды
- •29 Экономические рычаги охраны атмосферного воздуха.
- •30. Абсорбционный метод очистки газовых выбросов
- •31. Области применения абсорбционных аппаратов
- •32 Конструкционные особенности абсорбционных аппаратов
- •33 Методика расчета абсорбера
- •34 Виды адсорбентов и их применение.
- •35. Характеристика промышленных адсорбентов, требования к ним.
- •36. Конструкционные особенности адсорбционых аппаратов
- •37. Области применения адсорбционной техники
- •38. Очистка газов от оксида и диоксида углерода.
- •39. Очистка газов от сероводорода.
- •40. Очистка газов от оксидов серы.
- •41. Очистка газов от оксидов азота и аммиака.
- •42. Термический метод прямого сжигания газовых выбросов.
- •43. Особенности каталитического метода очистки газовых выбросов.
- •44. Типы каталитических реакторов
- •45 Методы конденсации, термофореза и диффузиофореза.
- •46. Технологические методы снижения количества оксидов азота в энергетике.
- •47. Демеркуризация территории и помещений.
- •48. Методы борьбы со свинцовым загрязнением.
- •49. Требования к эксплуатации газоочистного оборудования.
- •50. Очистка воздуха от микроорганизмов и неприятных запахов
- •51 Биохимический метод очистки газовых выбросов.
- •52 Ресурсосбережение при разработке систем очистки газовых выбросов.
- •53 Основные показатели и задачи ресурсосбережения.
- •54 Энергосбережение и вторичные энергоресурсы.
- •55. Основные приоритеты в области энергосбережения.
- •56 Безотходное и малоотходное производство.
- •57. Пути образования и состав аэрозолей
- •58. Плотность и дисперсность пыли
- •59. Адгезионные свойства, абразивность, смачиваемость пыли
- •60 Электрические свойства пыли.
- •61 Методы отборов проб пыли из газового потока.
- •62 Определение содержания пыли в воздухе.
- •63 Основные механизмы при пылеулавливании.
- •64 Расчет пылеосадительной камеры.
- •65 Гравитационное и инерционное пылеосаждение.
- •66.Классификация циклонов по форме корпуса и их характеристика.
- •67.Классификация циклонов по компоновке и их характеристики.
- •68 Конструкция циклонов ниогаз.
- •69 Конструкция циклонов сиот, стф-ц, вцнниот.
- •70. Механизмы осаждения пылевых частиц на фильтрах.
- •71. Характеристика волокнистых фильтров.
- •72 Характеристика тканевых фильтров
- •73 Особенности фильтровальных тканей
- •74. Принцип работы рукавных фильтров
- •75. Зернистые фильтры.
- •76. Ячейковые фильтры масляные фильтры
- •77 Рулонные фильтры и фильтр Петрянова.
- •78. Принципы работы электрофильтров.
- •79. Характеристика трубчатых и пластинчатых электрофильтров.
- •80 Расчет и выбор фильтра.
- •81 Характеристика полых и осадочных газопромывателей.
- •82 Характеристика тарельчатых и ударно-инерционных пылеуловителей.
- •83 Особенности работы скруббера Вентури
- •84 Брызгоунос и сепарация капель
39. Очистка газов от сероводорода.
H2S –бесцветный газ с характерным запахом, хорошо растворим в воде (1 объем Н2О и 3 объема H2S). Образуется слабая кислота. Сильно токсичен. При концентрации H2S в воздухе 0,004 мг/л ощущается сильный запах. При более высоких конц-ях возможно сильное отравление и смерть из-за остановки дыхания. ПДКSO2(рабочей зоны)=10 мг/м3; в присутствии СхНу -3 мг/м3. Максимально-разовое для населенных мест ПДК=0,008мг/м3.
Хорошо горит в присутствии кислорода :а) избыток О2 : 2H2S + 3О2 = 2Н2О + 2SO2
б) недостаток О2 : 2H2S + О2 = 2Н2О + 2S
Очистка промышленных газовых выбросов от H2S проводится как мокрым, так и сухим способами.Мокрый метод: газы контактируют с поглотительными растворами.Сухой метод: исп-ся сорбенты различной природы.
Сущ-т 5 методов очистки газов от H2S:
мышьяково-содовый Na4As2S5O2 + H2S = Na4As2S6O + Н2О (аб-ция)
Na4As2S6O + 1/2O2 = Na2As2S5O2 + S (реген-я)
Абсорбция и реген-ция проходит при т-ре = 40…45°С в аппаратах (скрубберах).
Достоинства: селективность очистки по отношению H2S и высокая эф-ть очистки (98%)
фосфатный метод H2S + К3РО4 = К2НРО4 + КНS
Ряд преимуществ по отн-нию к мышьяково-содовому: нелетучесть фосфата калия, что позволяет проводить процесс при более высоких т-рах. Исп-мый поглотительный раствор позволяет селективно выделять H2S из загрязненных газов, где его концентрация отн-но высока и присутствует знач-ное количество СО2.
Фосфат калия может взаим-ть с очищенным газом с выделением в аппаратах очистки нерастворимых карбонатов → процесс проводят с исп-нием 35% раствора фосфата калия.
ж
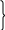 елезо-содовый
елезо-содовый
3NaHS + 2Fe(OH)3 = Fe2S3 + 3NaOH + 3H2O аб-ция
3NaHS + 2Fe(OH)3 = 2FeS + S +3NaOH + 3H2O
2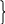 Fe2S3
+ 6H2O
+ 3O2
= 4Fe(OH)3
+ 6S реген-ция
Fe2S3
+ 6H2O
+ 3O2
= 4Fe(OH)3
+ 6S реген-ция
4FeS + 6H2O + 3O2 = 4Fe(OH)3 + 4S абсорбента
Щелочная среда д.б. при РН 8,5…9,0 , а при регенерации сульфиды железа окисляются кислородом с образованием элементарной серы (товарный продукт).
адсорбция цеолитами
H2S + NaA = H2S(NaA)
H2S(NaA) = H2S + NaA
Процесс ад-ции H2S можно проводить в присутствии СО2. На начальной стадии очистки из загрязненного газа извлекают как H2S, так и СО2. Затем H2S вытесняет из сорбента СО2 и содержание СО2 в выходящем газе начинает возрастать. Процесс м.б. остановлен при любом экономически и технологически оправданном содержании СО2 в очищаемой газ. среде.
адсорбция активированным углем
H2S + С + О
Здесь уголь –адсорбент и катализатор. Каталитические св-ва сорбента усиливают нанесением на его пов-ть йода и йодистого калия (I и KI). На пов-ть и в объеме пор сорбента образ-ся элементарная S → периодически проводят регенерацию угля.
40. Очистка газов от оксидов серы.
Сернистый газ –один из основных загрязнителей атм-го в-ха, оказывающий сильное негативное влияние на живые организмы. В атм-ре постоянно окисляется до серного ангидрида и при взаимодействии с водой образуется серная кислота. Из атм-ры сернистый газ вымывается с осадками, поступая в водоемы и почву. Время пребывания его в атм-ре зависит от многих факторов и составляет от нескольких часов до 3-5 суток. Среднесуточная ПДК составляет 0,005 мг/м3.
Наиболее распространенные след. методы очистки:
известковый метод очистки
SO2 + CaCO3 = CaSO3 + CO2
SO2 + CaO = CaSO3
SO2 + Ca(OH)2 = CaSO3 + H2O
2CaSO3 + O2 = 2CaSO4
Один из наиболее простых методов, но в процессе очистки образуются твердые отходы, кот-е не находят практического применения и сбрасываются в отвалы, поэтому метод применим при небольшом содержании SO2.
аммиачный метод очистки
SO2 + (NH4)2 + H2O = 2NH4HSO3
Имеется несколько вариантов, но во всех вариантах первая стадия одинакова –поглощается SO2 водным раствором сульфида аммония с образованием гидросульфида. Далее варианты различаются способом переработки гидросульфида аммония.
2NH4HSO3 + (NH4)2SO3 = 2(NH4)2SO4 + S + H2O
Происходит разложение NH4HSO3 при повышенных тем-рах и давлении с получением товарных продуктов (серы и сульфата аммония).
поглощение SO2 углеродным пористым сорбентом
При контакте газа, содержащего SO2, с пористым сорбентом в начале происходит сорбция SO2 на активной пов-ти сорбента. Далее в рез-те взаимодействия сорбированных вещ-в между собой образ-ся вещ-ва, представляющие собой товарные продукты.
SO2 + Н2О = Н2 SO3
Н2 SO3 + 1/2О2 = Н2 SO4
