
- •Атом-Наименьшая частица элемента, обладающая его химическими свойствами
- •Энергетическая диаграмма атома кислорода:
- •4. Теплота образования – изобарный тепловой эффект химической реакции образования данного химического соединения из простых веществ, отнесенный к одному молю этого соединения.
- •Следствия из закона Гесса:
- •Стандартные энтропии некоторых веществ.
- •6. Скорость химической реакции - это изменение концентрации реагирующих веществ в единицу времени.
- •11. Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц.
- •Закон Генри записывается обычно следущим образом:
- •12. Массовая доля это отношение массы растворенного вещества к общей массе раствора. Для бинарного раствора
- •Закон разведения Освальда.
- •Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окислительно-восстановительных.
- •Способы смещения равновесия в реакциях гидролиза
- •Максимальная разность потенциалов, возникающая при обратимой работе гальванического элемента, есть электродвижущая сила (эдс) гальванического элемента.
- •20. Электролиз водных растворов.
- •Электролиз расплавов.
- •Для вычисления степени окисления элемента следует учитывать следующие положения:
- •Все щелочные металлы реагируют с водой, восстанавливая ее до водорода. Активность взаимодействия металлов с водой увеличивается от лития к цезию.
Закон разведения Освальда.
Если первоначальная концентрация электролита C0, а степень диссоциации то
Kд= C02/1-
Для слабых электролитов: 1-
Kд C02
 Kд/
C0)
Kд/
C0)
15. Электролитическая диссоциация — распад вещества на ионы под действием полярных молекул растворителя или при расплавлении.
Вода, хотя и является слабым электролитом, в небольшой степени диссоциирует:
H2O + H2O ↔ H3O+ + OH−
или
H2O ↔ H+ + OH−
Равновесие этой реакции сильно смещено влево. Константу диссоциации воды можно вычислить по формуле:
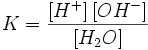
где:
[H+] — концентрация ионов гидроксония (протонов);
[OH−] — концентрация гидроксид-ионов;
[H2O] — концентрация воды (в молекулярной форме) в воде;
Водородный показатель (рН) - параметр, характеризующий концентрацию водородных ионов в растворе, т. е. степень его щелочности или кислотности. Показатель рН может изменяться от 0 до 14. Раствор, в котором рН равно семи, является нейтральным, ниже семи - кислым, выше - щелочным.
Буферные растворы (англ. buffer, от buff — смягчать удар) — растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NН3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щелочи, при разбавлении или концентрировании. Буферные растворы широко используют в различных химических исследованиях. Буферные растворы имеют большое значение для протекания процессов в живых организмах. Например, в крови постоянство водородного показателя рН поддерживается буферными смесями, состоящими из карбонатов и фосфатов. Известно большое число буферных растворов (ацетатно-аммиачный буферный раствор, фосфатный буферный раствор, боратный буферный раствор, формиатный буферный раствор и др.).
16. РЕАКЦИИ В РАСТВОРАХ, хим. р-ции, идущие между растворенными в-вами, а также между растворенным в-вом и р-рителем. Как правило, р-ритель принимает непосредств. участие в хим. взаимодействии. С одной стороны, р-ритель проявляет себя как сплошная среда (континуум), характеризующаяся вязкостью, диэлектрич. проницаемостью, поляризацией и т. п.; с другой стороны-как совокупность молекул, обладающих размером, дипольным моментом, поляризуемостью и участвующих в межмолекулярном взаимодействии друг с другом и с молекулами растворенного в-ва, к-рое м. б. описано соответствующими потенциалами. Молекулы р-ри-теля образуют упорядоченные структуры на расстояниях, сравнимых с межмолекулярными (ближний порядок), что отражается видом корреляц. ф-ции распределения (см. Жидкость).
Реакции ионного обмена. Условия их протекания до конца. Отличие реакций ионного обмена от окислительно-восстановительных.
Ответ можно начать с положения о том, что поскольку электролиты в растворах образуют ионы, то реакции в них происходят не между молекулами, а между ионами.
Если смешать растворы двух диссоциирующих веществ, то положительно заряженные ионы (катионы) взаимодействуют с ионами, заряженными отрицательно (анионы).
Это положение следует подтвердить примерами
1. Одно из образующихся веществ является малодиссоциирующим. Это может быть
а) осадок
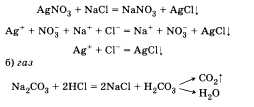
В результате реакции образуется угольная кислота, которая разлагается на газ оксид углерода (IV) и воду.

Все участвующие в реакции вещества находятся в виде ионов. Связывание их с образованием нового вещества не происходит, поэтому реакция в этом случае практически не осуществима.
Приведенные примеры свидетельствуют о том, что необходимыми условиями протекания реакций ионного обмена до конца являются: 1) образование осадка; 2) выделение газа; 3) образование малодиссоциирующих молекул воды.
Естественно, что в ходе ответа можно приводить другие примеры реакций ионного обмена, но при этом важно помнить об использовании таблицы «Растворимость кислот, оснований и солей в воде», из которой видно, какое вещество растворимо, а какое — нет.
Отличительной особенностью реакции ионного обмена от окислительно-восстановительных реакций является то, что они протекают без изменения степеней окисления, участвующих в реакции частиц.
17. Гидролиз (от греч. hydro – вода, lysis – разложение) означает разложение вещества водой. Гидролизом соли называют обратимое взаимодействие соли с водой, приводящее к образованию слабого электролита.
Вода хотя и в малой степени, но диссоциирует:
H2O H+ + OH–.
Хлорид натрия H2O H+ + OH–,
Na+ + Cl– + H2O Na+ + Cl– + H+ + OH–,
NaCl + H2O (нет реакции) Нейтральная
Kарбонат натрия + НОН + OН–,
2Na+ + + H2O + OН–,
Na2CО3 + H2O NaHCО3 + NaOН Щелочная
Хлорид алюминия Al3+ + НОН AlOH2+ + Н+,
Al3+ + 3Cl– + H2O AlОH2+ + 2Cl– + H+ + Cl–,
AlCl3 + H2O AlOHCl2 + HCl Kислая
