- •Первый закон термодинамики
- •Внутренняя энергия
- •Энтальпия
- •Энтропия
- •Термодинамические процессы идеальных газов в закрытых системах
- •Шарль (Charles), Жак Александр Сезар
- •12 Ноября 1746 г. – 7 апреля 1823 г.
- •Газовые законы в 1802 Гей-Люссак открыл закон теплового расширения газов, независимо от Дж. Дальтона.
- •Последние годы жизни
- •Человеческие качества
- •Личная жизнь
- •Интересные факты
- •Изотермный процесс (закон Бойля и Мариотта, 1662 г.)
- •Адиабатный процесс (закон Пуассона, 1823 г.).
- •Политропный процесс и его обобщающее значение.
- •Термотропный процесс
- •Характеристика теплообмена
- •Сопоставление термотропного и политропного процессов
- •Процессу, при термотропном процессе наступает максимум температуры.
- •Термотропный цикл
Термодинамические процессы идеальных газов в закрытых системах
Метод исследования процессов, не зависящий от их особенностей и являющийся общим, состоит в следующем:
- выводится уравнение процесса, устанавливающее связь между начальными и конечными параметрами рабочего тела в данном процессе;
- вычисляется работа расширения и располагаемая (техническая) работа газа;
- определяется количество теплоты, подведенной (или отведенной) к газу в процессе;
- определяется теплоёмкость процесса;
- определяется изменение внутренней энергии системы в процессе;
- определяется изменение энтальпии системы в процессе.
- определяется изменение энтропии системы в процессе.
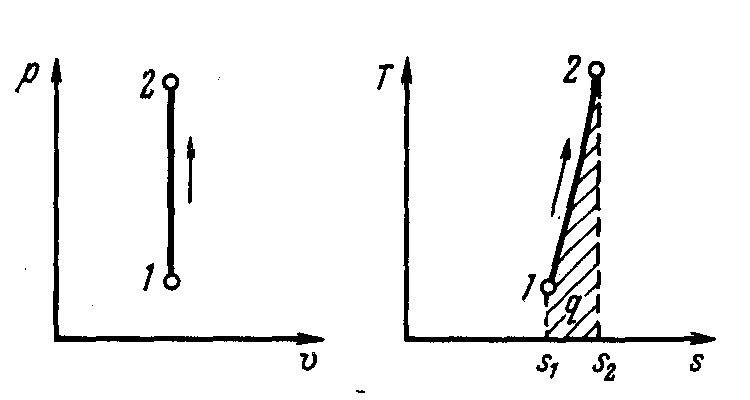
Изохорный процесс (закон Шарля). Закон открыт экспериментальным путём французским физиком Жаком Шарлем (1746-1823) в 1787 году.
При изохорном процессе выполняется условие v = const и dv = 0.
Из уравнений состояния идеального газа, составленных для точки 1 и точки 2
р1v1/p2v2 = T1/T2
следует, что давление газа в изохорном процессе (v1 = v2 сокращаются) прямо пропорционально его абсолютной температуре
р2 / р1 = Т2/Т1. (2)
|
Рис. 3. Изображение изохорного процесса в р, v- и Т, s - координатах |
Работа расширения pdv в этом процессе равна нулю, так как dv = 0
l = 0.
Располагаемая работа
p2
lpacп = -v ∫dp = v(p1 - p2 ).
p1
Количество теплоты, подведенной к рабочему телу в процессе 1- 2 при
теплоёмкости процесса сv = const, определяется из уравнения 1-го закона термодинамики
δq = du + δl :
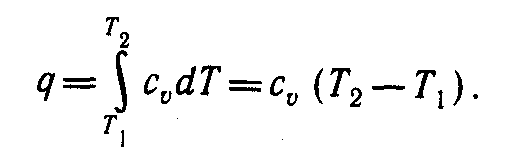 (3)
(3)
При переменной теплоемкости сv = var
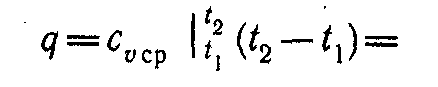
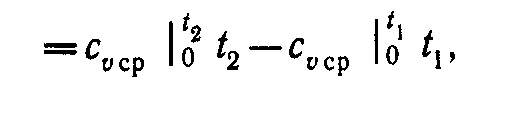 (4)
(4)
где
![]() —
средняя массовая изохорная теплоемкость
в интервале температур от t1
до t2.
—
средняя массовая изохорная теплоемкость
в интервале температур от t1
до t2.
Внутренняя энергия. Так как l = 0, то в соответствии с первым законом термодинамики Δ u = q и
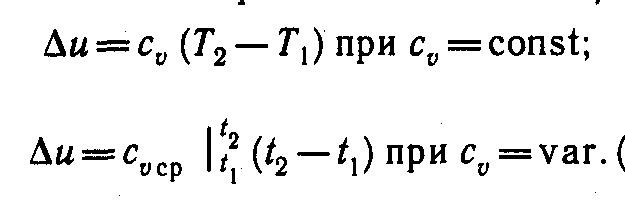
(5)
Поскольку внутренняя энергия идеального газа является функцией только его температуры, то формулы (5) справедливы для любого термодинамического процесса идеального газа.
Изменение энтальпии
Δi = cp (Т2 – Т1).
Изменение энтропии в изохорном процессе определяется из ранее полученной общей формулы:
s2 – s1 = .
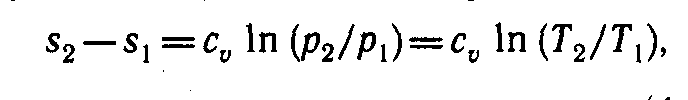
(6)
т. е. зависимость энтропии от температуры на изохоре при сv = const имеет логарифмический характер (см. рис. 3).
Об авторстве существуют противоречивые мнения.
1. Впервые гипотеза о пропорциональности давления и температуры была высказана в 1702 году французским физиком Гильомом Амонтоном. Однако точная формула соответствующего закона была получена лишь через сто лет французским учёным Ж. Л. Гей-Люссаком. В отечественной литературе этот закон иногда ошибочно называют законом Шарля. На самом деле французский учёный Шарль никакого отношения к этому закону не имеет. Закон о пропорциональности давления и температуры носит название Гей-Люссака.
2. Закон был открыт в 1787 году французским физиком Жаком Шарлем. Однако результаты своих экспериментов Шарль не опубликовал. Через 15 лет к тому же выводу независимо от Шарля пришли английский учёный Джон Дальтон и французский физик Жозев Луи Гей-Люссак. В отличие от Дальтона, Гей-Люссак сформулировал свой вывод более определённо, и притом в количественной форме. Поэтому новый газовый закон стали называть законом Гей-Люссака. Однако сам Гей-Люссак с благородством, которое редко можно встретить в вопросах приоритета, настоял на том, чтобы этот закон назвали в честь Шарля. С тех пор в западной литературе третий газовый закон называют законом Шарля.