- •Первый закон термодинамики
- •Внутренняя энергия
- •Энтальпия
- •Энтропия
- •Термодинамические процессы идеальных газов в закрытых системах
- •Шарль (Charles), Жак Александр Сезар
- •12 Ноября 1746 г. – 7 апреля 1823 г.
- •Газовые законы в 1802 Гей-Люссак открыл закон теплового расширения газов, независимо от Дж. Дальтона.
- •Последние годы жизни
- •Человеческие качества
- •Личная жизнь
- •Интересные факты
- •Изотермный процесс (закон Бойля и Мариотта, 1662 г.)
- •Адиабатный процесс (закон Пуассона, 1823 г.).
- •Политропный процесс и его обобщающее значение.
- •Термотропный процесс
- •Характеристика теплообмена
- •Сопоставление термотропного и политропного процессов
- •Процессу, при термотропном процессе наступает максимум температуры.
- •Термотропный цикл
ВЗАИМОДЕЙСТВИЕ ТЕРМОДИНАМИЧЕСКОЙ СИСТЕМЫ
С ВНЕШНЕЙ СРЕДОЙ
Изменение параметров состояния термодинамической системы происходит в результате её взаимодействия с внешней средой. Для закрытых систем оно выражается в обмене энергией. При обмене с внешней средой энергия выступает в виде либо теплоты, либо работы.
Обмен теплотой при контакте двух тел на внешней границе системы осуществляется на молекулярном уровне путём передачи энергии колебаний молекул. При отсутствии непосредственного контакта теплота может передаваться излучением. И в том и другом случае этот процесс возможен только при наличии разности температур между телами. Закономерности теплообмена между телами будут рассмотрены позже в разделе теории теплообмена.
Работа определяется произведением силы, действующей на рабочее тело системы, на путь её действия.
Единицей измерения теплоты и работы является Джоуль (Дж).
Под рабочим телом системы понимается масса материи, заключённая в оболочку, которая отделяет систему от окружающей среды. Единицей измерения рабочего тела являются килограмм (кг) или киломоль (кмоль).
В открытой системе кроме обмена теплотой и работой происходит также обмен массой, т.е.количество рабочего тела является переменной величиной.
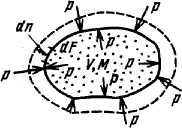
РАБОТА ГАЗОВ
|
Рис. 1. К определению работы расширения |
В открытых системах, где в системе движется поток рабочего тела (например, в турбинах или компрессорах), работа называется технической или располагаемой. В обозначение технической работы вводится нижний индекс, например, Lтех или Lрасп.
В случае, если в расчётах применяется не абсолютный объём V, а удельный v (т.е. объём, приходящийся на один кг рабочего тела), то вместо обозначения L используется обозначение l.
Таким образом, элементарное количество работы расширения равно
![]()
где р – давление в системе, v – удельный объём рабочего тела.
Элементарное количество технической работы равно
![]() .
.
Здесь элементарному количеству технической работы соответствует элементарное приращение давления.
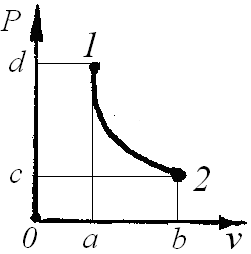
|
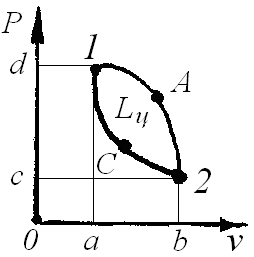
|
Рис. 1 |
Рис. 2 |
В координатах p – v работа расширения равна площади 1 – 2 –b – a, a техническая - площади 1 – 2 – c – d. (Рис. 1)
Если рабочее тело совершает круговой процесс (1, А, 2, С, 1, рис.2), то при его расширении по линии I, А, 2 совершается положительная работа расширения, равная по площади: 1, А, 2, b, a. При сжатии по линии 2, C, 1 над телом совершается работа, равная по площади 2, b, a, 1. Эта работа отрицательная. Разность площадей даёт суммарную (располагаемую) работу, совершённую рабочим телом в результате одного цикла Lц. Эта работа равна площади 1, А, 2, С, 1. Эта же площадь Lц получается при определении располагаемых работ.
Первый закон термодинамики
Первый закон термодинамики является законом сохранения энергии. Энергия, содержащаяся в системе, хотя и изменяется в результате взаимодействия с внешней средой путём обмена теплотой и работой, но в самой системе должна оставаться постоянной. Первый закон устанавливает не только постоянство энергии в системе, но и баланс отдельных видов энергии. Имеется ещё несколько формулировок первого закона термодинамики:
Энергия не возникает из ничего и не уничтожается в ничто.
Любая форма движения способна и должна превращаться в любую другую форму энергии.
Вечный двигатель первого рода невозможен (т. е. нельзя из “ничего” производить работу).
Первая форма дифференциального уравнения первого закона термодинамики для одного кг рабочего тела применяется в закрытых системах: цилиндры ДВС, поршневого компрессора
![]() ,
,
где q – теплота, сообщаемая рабочему телу, u – внутренняя энергия рабочего тела, l - работа расширения.
где р – давление в системе, v – удельный объём рабочего тела.
Параметры идеального газа объединены уравнением состояния.
Вторая форма дифференциального уравнения первого закона термодинамики для одного кг рабочего тела системы применяется в открытых системах, т.е. в условиях массообмена, где присутствует потока газа (центробежный компрессор, газотурбинный двигатель)
![]() ,
,
где q – теплота, сообщаемая рабочему телу, i – энтальпия, lтех – техническая (располагаемая) работа.
где р – давление в системе, v – удельный объём рабочего тела.
Размерности внутренней энергии и энтальпии рабочего тела такие же, как и у теплоты и работы – Дж или при отнесении к одному кг рабочего тела – Дж / кг.
Из уравнений первого закона термодинамики следует: тепловая или механическая энергия не могут возникать из ничего или превращаться в ничто. Они могут только превращаться взаимно друг в друга в эквивалентных количествах. Вечный двигатель первого рода невозможен.
В 1755 году французская Академия наук объявила, что больше не будет принимать к рассмотрению проекты вечных двигателей.
Внутренняя энергия
Внутренняя энергия системы является свойством материи. Внутренняя энергия на основании кинетической теории реального газа включает в себя:
-кинетическую энергию поступательного, вращательного и колебательного
движения частиц;
-потенциальную энергию взаимодействия частиц
-энергию электронных оболочек атомов;
-внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией реального газа будем понимать энергию хаотического движения молекул и атомов, включающую кинетическую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного вида, а также потенциальную энергию сил парных взаимодействия между молекулами.
При Т = 0 в атомах сохраняется только движение электронов и вн. энэ. при этом называется нулевой внутренней энергией.
Внутренняя энергия системы обозначается буквой U и определяется как функция параметров состояния и поэтому называется функцией состояния (в отличие от теплоты и работы, являющихся функциями процесса – мат. – неполными дифф.).
Принципиальным признаком функцией состояния служит то, что она является полным дифференциалом и потому при осуществлении процесса определяются только начальными и конечными значениям функции, не учитывая характер процесса (изохорный, изобарный или другой), т.е.
![]() .
.
В отличие от внутренней энергии функции тепла или работы не является полным дифференциалом и потому при осуществлении процесса определяются не только начальными и конечными значениям функции, но и учитывается характер процесса (т.е изменение и параметров состояния).Вследствие этого, например
![]() .
.
Кинетическая энергии молекул является функцией температуры и зависит от средней скорости молекул. Значение потенциальной энергии, возникающей при парном взаимодействии молекул, зависит от среднего расстояния между молекулами и, следовательно, является функцией удельного объема v.
Внутренняя энергия U идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления, а определяется только его температурой.
Для сложной системы, состоящей из смеси газов, она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности.
Величина u=U/M, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно.
Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление насыщенного водяного пара при этой температуре 610,8 Па, а для идеальных газов—при О °С вне зависимости от давления.
В дальнейшем для краткости будем называть величину и просто внутренней энергией.
Дифференциал внутренней энергии равен
![]() ,
,
где cv – истинная удельная массовая теплоёмкость при постоянном объёме, Т – температура рабочего тела.
В практических расчётах приращение внутренней энергии определяется формулой
![]()
где
![]() - средняя теплоёмкость при постоянном
объёме в интервале температур t1
и t2.
- средняя теплоёмкость при постоянном
объёме в интервале температур t1
и t2.