
Семестр 02 / Шпоры по физике 2 сем / Билеты по физике / Билет 4
.docx-
Уравнение состояния газа Ван-дер-Ваальса.
Для описания поведения газов в широком
интервале плотностей было предложено
много различных уравнений. Самым простым
из них и вместе с тем дающим достаточно
хорошие результаты оказалось уравнение
Ван-дер-Ваальса. Это уравнение получено
путем внесения поправок в уравнение
pVM=RT
(1.63) и имеет следующий вид:
 где p — давление,
оказываемое на газ извне (равное давлению
газа на стенки сосуда), а и b
— константы Ван-дер-Ваальса, имеющие
для разных газов различные значения,
определяемые опытным путем. Поправка
a/VM2
характеризует ту добавку к внешнему
давлению, которая обусловлена взаимным
притяжением молекул. Заметное
воздействие молекул друг на друга
осуществляется в пределах небольших
расстояний, называемых радиусом
молекулярного действия. Поправка
b в (1.64)
характеризует ту часть объема, которая
недоступна для движения молекул. Она
равна нескольким суммарным объемам
молекул, содержащихся в моле газа.
Уравнение (1.64) написано для одного моля
газа. Чтобы перейти к уравнению для
произвольной массы m,
нужно учесть, что
молей газа при тех же условиях занимают
в
раз больший объем: V=VM.
Заменив в (1.64) VM
на V/,
получим
где p — давление,
оказываемое на газ извне (равное давлению
газа на стенки сосуда), а и b
— константы Ван-дер-Ваальса, имеющие
для разных газов различные значения,
определяемые опытным путем. Поправка
a/VM2
характеризует ту добавку к внешнему
давлению, которая обусловлена взаимным
притяжением молекул. Заметное
воздействие молекул друг на друга
осуществляется в пределах небольших
расстояний, называемых радиусом
молекулярного действия. Поправка
b в (1.64)
характеризует ту часть объема, которая
недоступна для движения молекул. Она
равна нескольким суммарным объемам
молекул, содержащихся в моле газа.
Уравнение (1.64) написано для одного моля
газа. Чтобы перейти к уравнению для
произвольной массы m,
нужно учесть, что
молей газа при тех же условиях занимают
в
раз больший объем: V=VM.
Заменив в (1.64) VM
на V/,
получим
 Умножив это уравнение на
и введя обозначения a=2a,
b=b
(1.65) приходим к уравнению Ван-дер-Ваальса
для молей
Умножив это уравнение на
и введя обозначения a=2a,
b=b
(1.65) приходим к уравнению Ван-дер-Ваальса
для молей
 Буквами a'
и b'
обозначены константы Ван-дер-Ваальса
для молей.
Их связь с a и b
дается соотношениями (1.65). Уравнение
Ван-дер-Ваальса в пределе, при
стремлении объема к бесконечности,
переходит в уравнение (1.63).
Буквами a'
и b'
обозначены константы Ван-дер-Ваальса
для молей.
Их связь с a и b
дается соотношениями (1.65). Уравнение
Ван-дер-Ваальса в пределе, при
стремлении объема к бесконечности,
переходит в уравнение (1.63).
-
Число ударов молекул газа о стенку сосуда.
Рассмотрим находящийся в равновесии
газ, заключенный в некотором сосуде.
Возьмем элемент поверхности сосуда S
и подсчитаем число ударов молекул об
этот элемент за время t.
Выделим из N
молекул, заключенных в сосуде, те dNV
молекул, модуль скорости которых
лежит в пределах от V
до V+dV.
Из числа этих молекул направления
движения, заключенные внутри телесного
угла d.
будет иметь количество молекул, равное: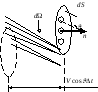

Из
выделенных таким образом молекул долетят
за время t
до площадки S
и ударятся о нее молекулы, заключенные
в косом цилиндре с основанием S
и высотой
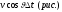 Число этих молекул равно
Число этих молекул равно
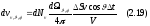 (V — объем сосуда). Чтобы получить полное
число уларов молекул о площадку S,
нужно просуммировать выражение
(2.19) по телесному углу 2
и по скоростям в пределах от 0 до VMAX,
где VMAX
- наибольшая скорость, которой могут
обладать молекулы в данных условиях.
Начнем с суммирования по направлениям.
Для этого представим d
в виде
(V — объем сосуда). Чтобы получить полное
число уларов молекул о площадку S,
нужно просуммировать выражение
(2.19) по телесному углу 2
и по скоростям в пределах от 0 до VMAX,
где VMAX
- наибольшая скорость, которой могут
обладать молекулы в данных условиях.
Начнем с суммирования по направлениям.
Для этого представим d
в виде и
произведем интегрирование выражения
(2.19) по
и
произведем интегрирование выражения
(2.19) по
 в пределах от 0 до /2
и по в пределах от
0 до 2:
в пределах от 0 до /2
и по в пределах от
0 до 2:
 Интегрирование по d
дает 2, интеграл по
Интегрирование по d
дает 2, интеграл по
 равен 1/2. Следовательно,
равен 1/2. Следовательно,
 Это выражение дает число ударов о
площадку S
за время t
молекул, летящих в направлениях,
заключенных в пределах телесного угла
2, и имеющих модуль
скорости от v до v+dv.
Суммирование по скоростям дает полное
число ударов молекул о площадку S
за время t:
Это выражение дает число ударов о
площадку S
за время t
молекул, летящих в направлениях,
заключенных в пределах телесного угла
2, и имеющих модуль
скорости от v до v+dv.
Суммирование по скоростям дает полное
число ударов молекул о площадку S
за время t:
 Выражение
Выражение
 представляет собой среднее значение
модуля скорости v. Заменив
в (2.21) интеграл произведением N<v>,
получим
представляет собой среднее значение
модуля скорости v. Заменив
в (2.21) интеграл произведением N<v>,
получим

Здесь
n=N/V
есть число молекул газа в единице объёма.
Наконец, разделив выражение (2.22) на S
и t,
найдём число ударов молекул газа на
единицу поверхности стенки в единицу
времени:
 .
.
-
Поверхностное натяжение.


