
- •1. Качественный анализ и его виды. Чувствительность и специфичность аналитической реакции.
- •2. Понятие группового реагента и частные реагента и частные реакции ионов в аналитической химии.
- •3. Аналитическая классификация катионов. Виды и принципы разделения катионов на аналитические группы.
- •4. Аналитическая классификация анионов.
- •5. Понятие о буферных растворах. Примеры. Буферная емкость.
- •6. Ионное произведение воды, водородный показатель.
- •7. Закон действующих масс, константа равновесия химической реакции.
- •8. Принцип Ле-Шателье- принцип подвижного равновесия обратимых химический реакций.
- •9. Идеальные и реальные растворы. Понятие активности.
- •11. Понятие растворимости, произведение растворимости.
- •12. Требования, предъявляемые к качественным реакциям.
- •13. Количественные характеристики процесса гидролиза, степень и константа гидролиза.
- •15. Теория электролитической диссоциации, молекулярные и ионные уравнения диссоциации.
- •16. Количественные характеристики процесса электролитической диссоциации.
- •17. Сильные и слабые электролиты. Характеристика и примеры.
- •19. Дробный и систематический методы качественного анализа.
- •20. Групповой реагент и частные реакции анионов 1-ой аналитической группы.
- •21. Групповой реагент и частные реакции анионов 2-ой аналитической группы.
- •23. Гидролиз солей и его значение для качественного анализа.
- •24. Составьте ионно-молекулярное и молекулярное уравнение гидролиза соли, раствор которого имеет: а) щелочную реакцию; б) кислую реакцию.
- •25. Понятие об окислительно-восстановительных потенциалах.
- •27. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: kcn, Na2co3, ZnSo4Какое значение рH у водных растворов этих солей?
- •28. Строение комплексных соединений.
- •29. Константа нестойкости и общая константа устойчивости комплексных соединений.
- •30. Приготовление растворов процентной концентрации (массовая доля).
- •31. Приготовление растворов нормальной концентрации.
- •32. Количественный анализ, виды и характеристика.
- •33. Гравиметрический анализ, классификация.
- •34. Метод осаждения в гравиметрическом анализе, ход анализа, расчеты.
- •35. Виды титриметрического анализа. Практические примеры.
- •36. Построение кривых титрования.
- •37. Материалы и оборудование гравиметрического анализа.
- •38. Материалы и оборудование титриметрического анализа.
- •39. Кислотно-основное титрование, характеристика. Расчеты.
- •40. Окислительно-восстановительное титрование, виды, расчеты.
- •41. Комплексонометрическое титрование. Практическое применение, расчеты.
- •42. Классификация титриметрических методов. Различные приемы титрования.
- •Виды титрования
- •43. Физико-химические методы анализа, достоинства и недостатки.
- •44. Потенциометрия, практическое использование.
- •45.Особенности перманганатометрического и иодометричеекого титрования, практические приемы, расчеты.
- •46. Колориметрические методы анализа, практические примеры.
- •47. Гравиметрический анализ. Виды весовых анализов.
- •48. Ход осадочного весового анализа. Величина фактора пересчета и ее смысл.
- •49. Групповой реагент и частные реакции анионов 3-ой аналитической группы.
- •50. Групповой реагент и частные реакции 4-ой аналитической группы катионов.
- •51. Групповой реагент и частные реакции 5-ой аналитической группы катионов.
- •52. Требования, предъявляемые к осаждаемой и весовой форме в гравиметрическом анализе.
- •53. Основные понятия объемного анализа. Момент эквивалентности.
- •54. Изменение окраски индикаторов. Интервал перехода индикатора и показатель титрования индикатора.
11. Понятие растворимости, произведение растворимости.
Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Произведение растворимости — произведение концентрации ионов малорастворимого электролита в его насыщенном растворе при постоянной температуре и давлении. Произведение растворимости — величина постоянная.
12. Требования, предъявляемые к качественным реакциям.
Требования к аналитическим реакциям и их особенности можно свести к следующим положениям: - выполнение анализа «сухим» или «мокрым» способом (сухой способ – это пирохимические методы, от греч. «пир» – огонь), сюда следует отнести пробы на окрашивание пламени при сгорании исследуемого вещества на петле платиновой (или нихромовой) проволочки с получением в результате окрашенного в характерный цвет пламени; получение цветных стекол или перлов за счет сплавления исследуемого вещества в петле платиновой проволки с бурой Nа2В4О710Н2О, хром дает зеленый, кобальт – синий, марганец – фиолетовый перлы, рассмотрение металлических «корольков», получающихся при прокаливании анализируемых минералов на древесном угле с помощью паяльной трубки; метод растирания твердого анализируемого вещества с твердым реактивом, например, при растирании смеси соли аммония с Са(ОН)2 выделяется аммиак. Анализ сухим способом применяется для экспресс-анализов или в полевых условиях для качественного и полуколичественного исследования минаралов и руд. Для проведения мокрого анализа исследуемое вещество должно быть переведено в раствор и в дальнейшем реакции идут как реакции обнаружения ионов; - аналитическая реакция должна протекать быстро и полно при соблюдении определенных условий: температуры, реакции среды и концентрации обнаруживаемого иона. - дробный и систематический анализ . Обнаружение ионов с помощью селективных и специфических реакций в отдельных порциях раствора, производимое в любой последовательности называют дробным анализом.
13. Количественные характеристики процесса гидролиза, степень и константа гидролиза.
Выше показано, что реакция чистой воды является нейтральной (рН = 7). Водные растворы кислот и оснований имеют, соответственно, кислую (рН < 7) и щелочную (рН > 7) реакцию. Практика, однако, показывает, что не только кислоты и основания, но и соли могут иметь щелочную или кислую реакцию — причиной этого является гидролиз солей.
Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей.
Рассмотрим гидролиз солей следующих основных типов:
1. Соли сильного основания и сильной кислоты (например, KBr, NаNО3) при растворении в воде не гидролизуются, и раствор соли имеет нейтральную реакцию.
2. Соли сильного основания и cлабой кислоты, например KClO, Nа2СО3, СН3СООNа, NаСN, Nа2S, К2SiO3. Запишем уравнение гидролиза ацетата натрия:
СН3СООNа + Н2О СН3СООН +NaОН
В результате реакции образовался слабый электролит — уксусная кислота. В ионном виде этот процесс можно записать так:
СН3СОО- + Н2О СН3СООН + ОН-
Таким образом, раствор СН3СООNа проявляет щелочную реакцию. При растворении солей многоосновных кислот гидролиз протекает ступенчато, например:
Nа2S + Н2О NaНS + NаОН
или в ионной форме
S2- + Н2О НS- + ОН-. (1)
Процесс (1) отражает гидролиз Nа2S по первой ступени.
Чтобы гидролиз прошел полностью, как правило, увеличивают температуру процесса:
НS- + Н2О Н2S + ОН-.
Таким образом, при растворении в воде соли сильного основания и слабой кислоты раствор приобретает щелочную реакцию вследствие гидролиза.
3. Соли слабого основания и сильной кислоты, например Аl2(SО4)3, FеСl2, СuВr2, NН4Сl.
Рассмотрим гидролиз хлорида железа (II):
FeCl2 + H2O Fe(OH)Cl + HCl. (2)
В ионном виде этот процесс можно записать так:
Fe2+ + H2O Fe(OH)+ + H+. (3)
По второй ступени гидролиз протекает следующим образом:
Fе(ОН)+ + Н2О Fе(ОН)2↓ + Н+ . (4)
Из реакций (2) — (3) ясно, что в результате гидролиза cолей слабого основания и сильной кислоты раствор приобретает кислую реакцию.
4. Соли слабого основания и слабой кислоты, например Аl2S3, Cr2S3, СН3СООNН4, (NН4)2СО3. При растворении в воде таких cолей образуются малодиссоциирующие кислота и основание:
СН3СООNН4 + Н2О СН3СООН + NН4ОН,
или в ионном виде:
СН3СОO- + NН4+ +Н2О СН3СООН + NН4ОН.
Реакция среды в растворах подобных солей зависит от относительной силы кислоты и основания. Другими словами, водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований.
Так, при гидролизе СН3СООNН4 реакция раствора будет слабощелочной, поскольку константа диссоциации гидроксида аммония (К = 6,3∙10-5) несколько больше константы диссоциации уксусной кислоты (К= 1,75∙10-5).
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Степень гидролиза aг (доля гидролизованных единиц)
Константа гидролиза - Кг
Константу гидролиза можно выразить через:
КW- ионное произведение воды
Кд - константа диссоциации
слабой кислоты (Кд.к)
основания (Кд.осн)
Кw = [H+].[OH–] = 10–14
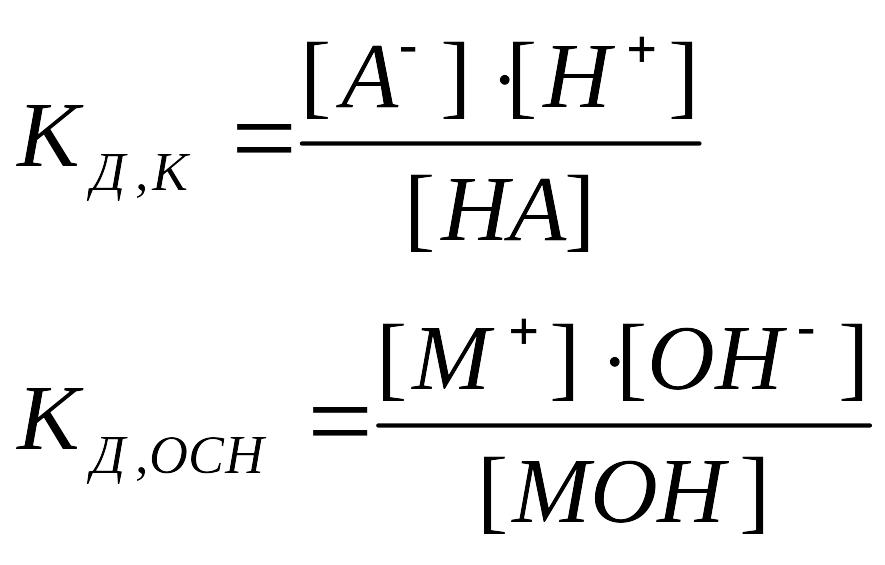
Пример: Гидролиз аниона
А- + Н2О→НА + ОН-

14. Три случая гидролиза солей, расчеты констант гидролиза для каждого из них. Рассмотрим наиболее типичные случаи гидролиза солей.
1. Соль, образованная слабым основанием и сильной кислотой (гидролиз по катиону).
NH4Cl+HOH<—>NH4OH+HCl
NH4+ +Cl-+HOH<—>NH4OH+H++ Cl-
NH4+ +HOH<—>NH4OH+H+
В растворе накапливаются ионы H+, в результате чего реакция смещается в кислую сторону, рН в растворах солей подобного типа меньше7.
2. Соль, образованная сильным основанием и слабой кислотой (гидролиз по аниону).
CH3COONa+HOH<—>CH3COOH+NaOH
CH3COO-+Na++HOH<—>CH3COOH+Na++OH-
CH3COO-+HOH<—>CH3COOH+OH-
В данном случае гидролиз ведет к увеличению концентраций ионов в растворе, среда щелочная, рН>7.
3. Соль, образованная слабой кислотой и слабым основанием (гидролиз по катиону и по аниону).
CH3COONH4 +HOH<—>CH3COOH+NH4OH
CH3COO- + NH4+ +HOH<—>CH3COOH+NH4OH
В результате гидролиза ацетата аммония происходит образование двух слабых электролитов, раствор оказывается близким к нейтральному, рН~7.
4. Соль, образованная сильным основанием и сильной кислотой.
Соли подобного типа гидролизу не подвергаются. Их ионы не образуют с ионами H+ и OH-воды слабодиссоциируюших или труднорастворимых соединений, равновесие между ионами и молекулами воды не нарушается и раствор остается нейтральным, рН равен 7.
