
- •1. Качественный анализ и его виды. Чувствительность и специфичность аналитической реакции.
- •2. Понятие группового реагента и частные реагента и частные реакции ионов в аналитической химии.
- •3. Аналитическая классификация катионов. Виды и принципы разделения катионов на аналитические группы.
- •4. Аналитическая классификация анионов.
- •5. Понятие о буферных растворах. Примеры. Буферная емкость.
- •6. Ионное произведение воды, водородный показатель.
- •7. Закон действующих масс, константа равновесия химической реакции.
- •8. Принцип Ле-Шателье- принцип подвижного равновесия обратимых химический реакций.
- •9. Идеальные и реальные растворы. Понятие активности.
- •11. Понятие растворимости, произведение растворимости.
- •12. Требования, предъявляемые к качественным реакциям.
- •13. Количественные характеристики процесса гидролиза, степень и константа гидролиза.
- •15. Теория электролитической диссоциации, молекулярные и ионные уравнения диссоциации.
- •16. Количественные характеристики процесса электролитической диссоциации.
- •17. Сильные и слабые электролиты. Характеристика и примеры.
- •19. Дробный и систематический методы качественного анализа.
- •20. Групповой реагент и частные реакции анионов 1-ой аналитической группы.
- •21. Групповой реагент и частные реакции анионов 2-ой аналитической группы.
- •23. Гидролиз солей и его значение для качественного анализа.
- •24. Составьте ионно-молекулярное и молекулярное уравнение гидролиза соли, раствор которого имеет: а) щелочную реакцию; б) кислую реакцию.
- •25. Понятие об окислительно-восстановительных потенциалах.
- •27. Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей: kcn, Na2co3, ZnSo4Какое значение рH у водных растворов этих солей?
- •28. Строение комплексных соединений.
- •29. Константа нестойкости и общая константа устойчивости комплексных соединений.
- •30. Приготовление растворов процентной концентрации (массовая доля).
- •31. Приготовление растворов нормальной концентрации.
- •32. Количественный анализ, виды и характеристика.
- •33. Гравиметрический анализ, классификация.
- •34. Метод осаждения в гравиметрическом анализе, ход анализа, расчеты.
- •35. Виды титриметрического анализа. Практические примеры.
- •36. Построение кривых титрования.
- •37. Материалы и оборудование гравиметрического анализа.
- •38. Материалы и оборудование титриметрического анализа.
- •39. Кислотно-основное титрование, характеристика. Расчеты.
- •40. Окислительно-восстановительное титрование, виды, расчеты.
- •41. Комплексонометрическое титрование. Практическое применение, расчеты.
- •42. Классификация титриметрических методов. Различные приемы титрования.
- •Виды титрования
- •43. Физико-химические методы анализа, достоинства и недостатки.
- •44. Потенциометрия, практическое использование.
- •45.Особенности перманганатометрического и иодометричеекого титрования, практические приемы, расчеты.
- •46. Колориметрические методы анализа, практические примеры.
- •47. Гравиметрический анализ. Виды весовых анализов.
- •48. Ход осадочного весового анализа. Величина фактора пересчета и ее смысл.
- •49. Групповой реагент и частные реакции анионов 3-ой аналитической группы.
- •50. Групповой реагент и частные реакции 4-ой аналитической группы катионов.
- •51. Групповой реагент и частные реакции 5-ой аналитической группы катионов.
- •52. Требования, предъявляемые к осаждаемой и весовой форме в гравиметрическом анализе.
- •53. Основные понятия объемного анализа. Момент эквивалентности.
- •54. Изменение окраски индикаторов. Интервал перехода индикатора и показатель титрования индикатора.
35. Виды титриметрического анализа. Практические примеры.
Титриметрический анализ использует различные типы химических реакций:
нейтрализации (кислотно-основное титрование) — нейтрализация — это реакции с изменением pH растворов.
Окисления-восстановления (перманганатометрия, иодометрия, хроматометрия) — реакции, которые происходят с изменением окислительно-восстановительных потенциалов в системе титрования.
Осаждения (аргентометрия) — реакции, протекающие с образованием малорастворимого соединения, при этом изменяются концентрации осаждаемых ионов в растворе.
Комплексообразования (комплексонометрия) — реакции, основанные на образовании прочных комплексных соединений ионов металлов (всех, кроме одновалентных) с комплексоном III (двунатриевой солью этилендиаминтетрауксусной кислоты), при этом изменяются концентрации ионов металлов в титруемом растворе.
Титрование — процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки. Титровать, начиная от других отметок, не рекомендуется, так как шкала бюретки может быть неравномерной. Заполнение бюреток рабочим раствором производят через воронку или с помощью специальных приспособлений, если бюретка полуавтоматическая. Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т. д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа.
Типы титрования
Различают прямое, обратное титрование и титрование заместителя.
При прямом титровании к раствору определяемого вещества (аликвоте или навеске, титруемому веществу) добавляют небольшими порциям раствор титрант (рабочий раствор).
При обратном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют его остаток, не вступивший в реакцию.
При заместительном титровании к раствору определяемого вещества добавляют сначала заведомый избыток специального реагента и затем титруют один из продуктов реакции между анализируемым веществом и добавленным реагентом.
36. Построение кривых титрования.
Кривые титрования в методе нейтрализации представляют собой графическое изображение изменения рН раствора в процессе титрования в зависимости от количества добавленного титранта
В зависимости от относительной силы кислот и оснований, участвующих в реакции, различают различные случаи титрования, каждый из которых описывается собственной кривой титрования. Ниже будут рассмотрены четыре типа построения кривых титрования: титрование сильных и слабых кислот сильным основанием; титрование сильных и слабых оснований сильными кислотами.
При построении кривых титрования выделяют следующие основные области расчета рН:
расчет рН до начала титрования;
в процессе титрования до точки эквивалентности;
в точке эквивалентности;
после достижения точки эквивалентности.
До начала титрования значение рН титруемого раствора определяется концентрацией (для сильных кислот и оснований) и константой диссоциации (для слабых кислот и оснований) титруемого раствора; после точки эквивалентности – концентрацией титранта.
В промежуточных точках титрования факторы, определяющие рН титруемого раствора, различны и зависят от того, какое вещество титруют.
Особое значение имеет расчет скачка на кривой титрования. Скачок титрования – это резкое изменение рН вблизи точки эквивалентности. Начало скачка соответствует недостатку в 0,1 % прибавленного титранта (т. е. добавлено 99,9 % титрата), а конец скачка соответствует избытку добавленного титранта в количестве 0,1 %. Скачок титрования – наиболее существенная часть кривой титрования, т. к. именно по нему производят выбор индикатора.
Величина и положение (по шкале pH) скачка титрования зависят от силы титруемой кислоты и основания. Чем больше скачок на кривой титрования, тем меньше погрешность титрования, связанная с выбором индикатора.
Анализ кривой титрования
В начале титрования рН изменяется очень медленно. С уменьшением концентрации оставшейся кислоты изменение рН при титровании становится более резким. Величина скачка рН на кривой титрования в данном случае достаточно велика и составляет 5,4 единицы:
ΔрН = рН конца скачка - рН начала скачка = 9,7 - 4,3 = 5,4.
Кривая титрования симметрична относительно точки эквивалентности, которая лежит в нейтральной среде. Величина скачка титрования зависит от концентрации реагирующих веществ. Чем меньше концентрация реагентов, тем меньше скачок титрования. К уменьшению скачка титрования приводит повышение температуры, т. к. возрастает величина ионного произведения воды (при 80° С скачок составляет, например, 4,6 единицы).
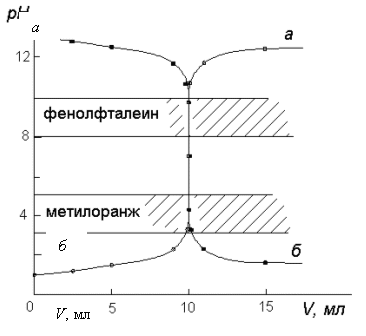
Рис.7.4.1. Кривые титрования:
а - кривая титрования 10,0 мл 0,1 М HCl раствором 0,1 М NaOH;
б - кривая титрования 10,0 мл 0,1 М NaOH раствором 0,1 М HCl
