
- •Законы Фарадея. Дискретность электрических зарядов.
- •Ток в газах.
- •Несамостоятельный газовый разряд.
- •Самостоятельный газовый разряд.
- •Электрический ток в вакууме. Эмиссионные явления.
- •Диод и триод.
- •Электроннолучевая трубка.
- •Классическая теория электропроводности металлов (теория Друде-Лоренца).
- •Вывод основных законов электрического тока.
- •Зонная теория твердого тела.
- •Контакт двух металлов по зонной теории.
- •Контакт металл - полупроводник по зонной теории.
- •Термоэлектронные явления и их применение.
Электричество и магнетизм.
Лекция 4.
Электрический ток в неметаллических средах. Термоэлектронная эмиссия. Принцип Паули. Функция распределения Ферми-Дирака. Элементы зонной теории твердого тела. Контакт двух металлов. Контактная разность потенциалов. Термоэлектрические явления. Контакт металл-полупроводник. Собственная и примесная проводимость полупроводников. Электронно - дырочный переход. Диод. Транзистор. Заряд и разряд конденсаторов в RC-цепях. Ламповый диод и триод. Электронно-лучевая трубка. Контактная разность потенциалов. Термопара.
Электрический ток в неметаллических средах.
Ток в жидкостях. Электролиз.
Электролизом наз. процесс выделения составных частей химических соединений на электродах при прохождении тока через раствор или расплав этих соединений.
Растворы некоторых химических соединений в воде или в других растворителях, а также расплавы, проводящие электрический ток, наз. электролитами.
Вещества, молекулы которых в растворе или расплаве распадаются на ионы, наз электролитами. Такой процесс распада наз. электролитической диссоциацией.
К электролитам относятся растворы многих солей, кислот и щелочей, а также расплавы солей и окислов металлов. Электролиты иначе наз. проводниками II рода (металлы – I рода).
Проводимость растворов электролитов
называется ионной проводимостью –
упорядоченное
движение ионов под действием внешнего
электрического поля. Объясняется
она так: молекулы многих веществ (напр.,
солей) представляют собой положительные
и отрицательные ионы, соединенные в
одно целое силой взаимного притяжения
![]() ,
,
![]() .
В воде
.
В воде
![]() сила взаимного притяжения между ионами
противоположных знаков уменьшается (в
81 раз). При таком ослаблении связи
тепловое движение молекулы может
оказаться достаточным для распада
(диссоциации)
ее на положительные и отрицательные
ионы.
сила взаимного притяжения между ионами
противоположных знаков уменьшается (в
81 раз). При таком ослаблении связи
тепловое движение молекулы может
оказаться достаточным для распада
(диссоциации)
ее на положительные и отрицательные
ионы.
Степенью диссоциации
![]() называется
отношение числа молекул
называется
отношение числа молекул
![]() ,
диссоциировавших на ионы, к общему числу
,
диссоциировавших на ионы, к общему числу
![]() молекул вещества:
молекул вещества:
![]() .
.
Степень диссоциации
зависит от температуры, концентрации
раствора и относительной диэлектрической
проницаемостью растворителя. Часть
ионов противоположных знаков «встречается»
при своем беспорядочном тепловом
движении и вновь образует молекулы
(процесс соединения ионов в молекулы
наз. рекомбинацией).
С течением времени наступает момент,
когда скорости диссоциации и рекомбинации
ионов сравниваются и возникает
динамическое равновесие, хотя процессы
распада и соединения не прекращаются,
соотношение распавшихся и нераспавшихся
молекул вещества в растворе сохраняется
постоянным:
![]() ,
,
![]() .
.
И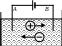 оны
в растворе, как и молекулы, движутся
хаотически. При подключении источника
тока к электродам (проводники,
соединенные с источником тока),
опущенным в такой раствор, возникает
направленное движение заряженных ионов.
Положительные ионы движутся к
отрицательному электроду – катоду,
поэтому они наз. катионами;
отрицательные ионы – анионы
движутся к положительному электроду –
аноду. Достигнув поверхности катода,
катион снимает с него недостающие для
нейтрализации электроны и превращается
в молекулу данного вещества; в то же
время анион, достигнув поверхности
анода, отдает ему свои лишние электроны,
также превращаясь в нейтральную молекулу.
Взамен исчезнувших ионов в электролите
появляются новые. Внешне явление
протекает таким образом, как будто
электроны от источника тока движутся
по замкнутой цепи: источник – электролит
– источник.
оны
в растворе, как и молекулы, движутся
хаотически. При подключении источника
тока к электродам (проводники,
соединенные с источником тока),
опущенным в такой раствор, возникает
направленное движение заряженных ионов.
Положительные ионы движутся к
отрицательному электроду – катоду,
поэтому они наз. катионами;
отрицательные ионы – анионы
движутся к положительному электроду –
аноду. Достигнув поверхности катода,
катион снимает с него недостающие для
нейтрализации электроны и превращается
в молекулу данного вещества; в то же
время анион, достигнув поверхности
анода, отдает ему свои лишние электроны,
также превращаясь в нейтральную молекулу.
Взамен исчезнувших ионов в электролите
появляются новые. Внешне явление
протекает таким образом, как будто
электроны от источника тока движутся
по замкнутой цепи: источник – электролит
– источник.
Т.о. электрический
ток в электролитах представляет собой
направленное движение ионов в растворе
под действием электрического поля в
обоих направлениях: положительных ионов
к катоду и отрицательных – к аноду.
Положительными
ионами явл. ионы металлов и водорода,
отрицательными – ионы кислотных остатков
![]() ,
,
![]() и т.д. и гидроксила
и т.д. и гидроксила
![]() .
.
Законы Фарадея. Дискретность электрических зарядов.
Законы Фарадея для электролиза определяют массу вещества, выделяющуюся на электродах при электролизе.
Заряд, отдаваемый
электроду
![]() ионами, равен:
ионами, равен:
![]() ,
где
,
где
![]() валентность
иона. С другой стороны масса
валентность
иона. С другой стороны масса
![]() выделившегося
на электроде вещества:
выделившегося
на электроде вещества:
![]() ,
где
,
где
![]() масса
одного иона. Получаем
масса
одного иона. Получаем
![]() или
или
Первый закон
Фарадея.
прямо пропорциональна количеству
электричества (заряду), прошедшего через
электролит:
![]() ,
где
,
где
![]() масса
выделившегося вещества,
масса
выделившегося вещества,
![]() заряд, прошедший через электролит,
заряд, прошедший через электролит,
![]() коэффициент
пропорциональности, который называется
электрохимическим эквивалентом
данного вещества.
коэффициент
пропорциональности, который называется
электрохимическим эквивалентом
данного вещества.
![]() .
.
Электрохимический эквивалент вещества численно равен массе данного вещества, выделившегося из электролита на одном из электродов при прохождении через электролит единицы электрического заряда. Единицы: кг/Кл.
Известно, что в
одной грамм-молекуле
![]() любого вещества (т.е.
в массе вещества в граммах, численно
равной молекулярному весу
любого вещества (т.е.
в массе вещества в граммах, численно
равной молекулярному весу
![]() )
содержится одинаковое число атомов:
)
содержится одинаковое число атомов:
![]() число
Авогадро.
Тогда масса иона:
число
Авогадро.
Тогда масса иона:![]() и
и
![]() .
.
Получаем
![]() .
Обозначим
.
Обозначим
![]() ,
где
,
где
![]() химический
эквивалент вещества.
химический
эквивалент вещества.
Химический
эквивалент
равен молярной массе
![]() ,
деленной на валентность
,
деленной на валентность
![]() .
Величина
безразмерная, численно равная массе
данного вещества в граммах, которая
замещает в химических соединениях
1,0078 г водорода.
.
Величина
безразмерная, численно равная массе
данного вещества в граммах, которая
замещает в химических соединениях
1,0078 г водорода.
Второй закон
Фарадея.
Электрохимические эквиваленты различных
веществ прямо пропорциональны их
химическим эквивалентам:
![]() ,
где
,
где
![]() или
или![]() ,
,
![]() постоянная
Фарадея,
постоянная
Фарадея,![]() .
.
Электрохимический
эквивалент
![]() .
.
Выразим оба
закона Фарадея одной формулой:
![]() ,
или
,
или
![]() .
Физический смысл:
для того, чтобы
на электроде выделилось количество
вещества, равное одному грамм-эквиваленту,
т.е.
.
Физический смысл:
для того, чтобы
на электроде выделилось количество
вещества, равное одному грамм-эквиваленту,
т.е.
![]() ,
через электролит надо пропустить заряд
,
через электролит надо пропустить заряд
![]() .
.
Постоянная
Фарадея:
![]() .
Опытами установлено, что
.
Опытами установлено, что
![]() .
.
Электрический
заряд
![]() любого иона:
любого иона:
![]() .
Заряд одновалентного иона численно
равен заряду электрона. Поэтому заряд
электрона может быть вычислен:
.
Заряд одновалентного иона численно
равен заряду электрона. Поэтому заряд
электрона может быть вычислен:
![]() .
.
Удельная проводимость электролитов:
![]()
![]() ,
где
,
где
![]() степень
диссоциации,
степень
диссоциации,
![]() [моль/м3]
– молярная концентрация,
валентность,
постоянная Фарадея,
[моль/м3]
– молярная концентрация,
валентность,
постоянная Фарадея,
![]() и
и
![]()
![]() - подвижности ионов.
- подвижности ионов.
Величина
![]() [моль/м3]
наз. эквивалентной концентрацией.
Величина
[моль/м3]
наз. эквивалентной концентрацией.
Величина
![]()
![]() наз. эквивалентной проводимостью.
наз. эквивалентной проводимостью.
Плотность электрического тока
в электролитах подчиняется закону Ома
для плотности тока:
![]() ,
где
,
где
![]() напряженность
поля;
напряженность
поля;
![]()
![]() число ионов каждого знака (число
пар ионов),
находящихся в единице объема электролита.
число ионов каждого знака (число
пар ионов),
находящихся в единице объема электролита.
Техническое применение электролиза основано на том, что приблизившиеся к электродам ионы превращаются в молекулы и либо выделяются из раствора на электродах, либо вступают во вторичные реакции с веществом электродов или раствора.
Задача 1. Никелирование пластинки
производится при плотности тока
![]() .
С какой скоростью растет толщина никеля?
Молярная масса никеля
.
С какой скоростью растет толщина никеля?
Молярная масса никеля
![]() ,
валентность
,
валентность
![]() ,
плотность
,
плотность
![]() .
.
 Дано:
Решение:
Дано:
Решение:
Пусть
![]() площадь
пластинки,
площадь
пластинки,
![]() толщина
покрытия. Тогда скорость нарастания
слоя покрытия
толщина
покрытия. Тогда скорость нарастания
слоя покрытия
![]() .
По первому закону Фарадея масса
выделившегося никеля
.
По первому закону Фарадея масса
выделившегося никеля
![]() .
С другой стороны
.
С другой стороны
![]() .
.
![]()
![]() ,
,
![]()
![]()
![]()
![]() и
и
![]()

![]()
Ответ:
![]() .
.
Задача 2. Электрон виде медной
пластины площадью 25 см2 погружен
в электролитическую ванну с раствором
медного купороса. При прохождении тока,
плотность которого
![]() ,
на пластине выделилось 100 мг меди.
Определить время пропускания тока.
Считать медь двухвалентной. Молярная
масса меди
,
на пластине выделилось 100 мг меди.
Определить время пропускания тока.
Считать медь двухвалентной. Молярная
масса меди
![]() .
.
Р
Дано:
,
,
,

![]() ,
,
![]()
![]()
По
первому закону Фарадея масса выделившегося
никеля
![]() ,
откуда
,
откуда
![]() .
Т.к.
,
.
Т.к.
,
![]()
![]() . Подставив численные значения, получим
. Подставив численные значения, получим
![]()
О твет:
твет:
![]() .
.
Сопротивление
электролитов уменьшается с увеличением
температуры. Температурный коэффициент
сопротивления электролита
![]() ,
где
,
где
![]()
![]() и
и
![]() сопротивления при температурах
сопротивления при температурах
![]() и
и
![]() С.
С.
