
- •В. М. Еськов, в. А. Папшев, в.А. Цейтлин биофизика
- •Моделирование динамики роста и развития организма человека – пример обратных связей в природе Цель работы:
- •Блок информации
- •Блок информации
- •1. Понятие динамических систем в живой и неживой природе.
- •2. Стационарные режимы биологических динамических систем (бдс).
- •3. Методы идентификации бдс в стационарных режимах (ср).
- •Моделирование эпизоотий в экосистемах. Устойчивость систем "хищник- жертва", "паразит- хозяин"
- •Блок информации
- •1. Модель популяционного взрыва.
- •2. Моделирование внутривидовой и межвидовой конкуренции.
- •3. Распространение заболеваний в популяциях. Построение эпидемической кривой.
- •Лабораторная работа № 1.4 оптически активные вещества. Поляриметрия
- •Блок информации
- •Лабораторная работа № 1.5 электрокинетические явления (экя) в биологических объектах. Определение X- потенциала дрожжевых клеток Цель работы
- •Блок информации
- •Практическое значение работы:
- •Бюджет времени
- •Графическое и динамическое моделирование реакций
Блок информации
В биологических объектах мы имеем дело со сложными гетерогенными системами, которые с физической точки зрения представляют собой различные дисперсные фазы (например, плазма крови, протоплазма живых клеток, лимфа). В таких сложных системах при движении дисперсных сред относительно дисперсионной (водные растворы белков и солей) среды возникают электрокинетические явления. Если наблюдается движение одной из фаз по отношению к другой под действием внешнего электрического поля, то эта группа явлений называется электроосмосом или электрофорезом. В частности, электрофорез - это движение дисперсной фазы по отношению к дисперсионной среде во внешнем электрическом поле, а электроосмос движение дисперсионной среды относительно неподвижной дисперсной фазы (в капиллярах, в пористых перегородках) под действием электрического поля.
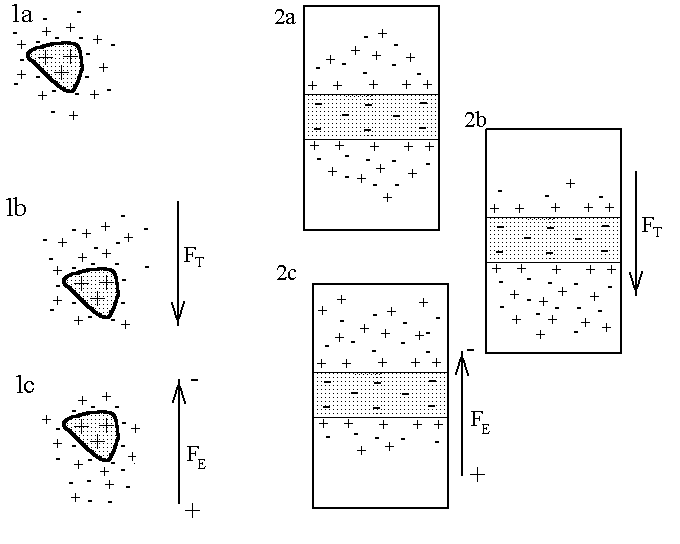
Рис. 1. Механизм появления электрокинетических явлений
(пояснения в тексте).
Возможна и другая физическая картина- возникновение разности потенциалов в направлении относительного движения фаз, вызываемого механическими силами, например, потенциалы оседания (седиментации), возникающие в гетерогенной системе под влиянием силы тяжести между верхними и нижними слоями системы, или потенциалы течения (протекания), возникающие в результате движения жидкости через капилляр или через поры пористой перегородки под действием разности давлений Dr на концах капилляра.
В основе всех наблюдаемых явлений находится относительное движение ионных слоев и пространственное разделение зарядов (поляризация) в направлении движения фаз. Для электрокинетических явлений (ЭКЯ) характерно возникновение на границе фаз избыточных зарядов, которые образуют два противоположно заряженных слоя т.н. двойной электрический слой (ДЭС), в котором электрический потенциал изменяется скачком. Это явление имеет место во многих случаях. Заряд центральной частицы и ионной атмосферы всегда противоположен, поэтому под действием электрического поля на частицу и её атмосферу влияют силы противоположной направленности. Важно, что ионы ДЭС входят в неё динамически, т.е. одни входят, другие уходят при общем сохранении электрической нейтральности. При рассмотрении ЭКЯ можно заметить взаимную обратность электроосмоса потенциалам течения и электрофореза потенциалам оседания. Для случаев электроосмоса и потенциалов течения мембрану можно считать дисперсной фазой. Тогда получим единую картину: равновесное распределение зарядов на частицах (рис. 1.1а) и на дисперсной мембране (рис. 1.2а.) обеспечивает электрическую нейтральность, силовое воздействие нарушает состояние нейтральности. Под действием силы тяжести частица (рис.1.1b) опускается вниз, но ионная атмосфера отстает и в результате происходит пространственное разделение зарядов. В электрическом поле ионы раствора и частица двигаются по силовым линиям, но в разные стороны, видимое движение одной центральной частицы объясняется малым количеством ионов, необходимых для создания ионной атмосферы (рис.1.1с). Для потенциала течения и электроосмоса логика аналогичная: при протекании раствора через перегородку (рис. 1.2b) ионы раствора участвуют в ДЭС и в результате ионы одного знака отстают от ионов другого знака и по разные стороны перегородки образуется разность потенциала (потенциал течения), а в электроосмосе ионы раствора, двигаясь по силовым линиям поля, несут с собой молекулы растворителя. Таким образом видно, что все ЭКЯ определяются прежде всего строением ДЭС.
Механизм образования ДЭС в разных системах различен. Например, на поверхности металлов часть электронов несколько выходят за пределы решетки, состоящей из положительных ионов и ДЭС в этом случае вносит свой вклад в работу выхода электронов из металла. Если металл поместить в электролит, содержащие ионы этого металла, то образуется дополнительный ионный ДЭС возникающий в результате ориентации полярных молекул растворителя (например, Н2О) у поверхности металла. Так, например, если погрузить пластинку Аg (электрод) в электролит, содержащий Аg+ , то эти ионы переходят из металла в раствор (частичное растворение) а избыточные электроны в металле заряжают его поверхность отрицательно и притягивают из раствора катионы (в физрастворе это К+ , Na+), которые образуют у поверхности вторую (положительную) обкладку ДЭС. Возникающий скачок потенциала Dj приостанавливает дальнейший переход Аg+ в раствор и наступает равновесие. Если же концентрация Аg+ во внешнем растворе велика, то возможен обратный переход и заряд ДЭС инвертируется. Могут существовать условия, при которых поверхность металла не заряжается. Например, если некоторый металл, который используют в качестве отводящих или стимулирующих электродов в биофизических исследованиях (электрофизиологии) (Zn, Аg) находится
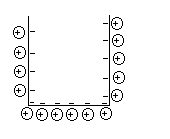

Рис.2 Рис.3
в насыщенных растворах собственных солей (Аg- AgCl, Zn- ZnSO4), то металлические электроды не поляризуются. В данной работе используются электроды Сu- CuSO4. Так как концентрация ионов Cu++ велика, а сами ионы Cu++ и SO42- токсичны для дрожжевых клеток, то к раствору с биологическими объектами электроды подсоединяются через промежуточный сосуд с насыщенным раствором KCl через трубки с раствором агар-агара значительно ограничивающего подвижность токсичных ионов (см.рис.3). На ионы ДЭС действуют электростатические силы теплового движения, в результате вблизи поверхности электрода образуются плотный ДЭС (слой Гельмгольца- Штерна) и на некотором расстоянии диффузный ДЭС (слой Гуи - Чепмена), который зависит от температуры среды, и от концентрации раствора.
Двойной электрический слой может образоваться и на поверхности биологических мембран (БМ). Известно, что структурной основой многих БМ являются фосфолипидные бимолекулярные слои, которые обеспечивают барьерную функцию БМ для ионов и водорастворимых молекул и являются матрицей для мембранных ферментов, различных белковых комплексов, обеспечивающих специфический транспорт веществ в клетке. В плазматических мембранах многих клеток к липидам примыкает гликокалипс, содержащий гликолипиды и гликопротеиды.
Важным свойством фосфолипидов является амфифильность- часть молекулы полярна (гидрофильна), а другая часть- неполярна (гидрофобна). Молекула фосфолипидов на 1/4 своей длины гидрофильна, а на 3/4 гидрофобна. В результате в водных растворах такие молекулы собираются произвольно в комплексы, которые замыкаются образуя везикулы- липосомы (3) или мицеллы (4) (рис.5). Образование липосом происходит произвольно и объясняется только силами кулоновского взаимодействия между полярными группами фосфолипидов.
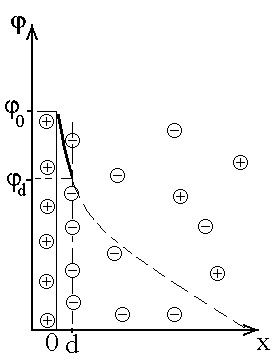
Рис.4 Строение ДЭС: 0d- плотный слой Гельмгольца- Штерна,
в диффузной части ДЭС присутствуют ионы обоих знаков.
Наружные
полярные (гидрофильные) молекулы создают
на поверхности БМ некоторый заряд
(преимущественно отрицательный), который
препятствует их слипанию, а в самой БМ
возникает межфазный скачек потенциала
того же знака, что и заряд на мембране.
Поверхностная концентрация одновалентных
заряженных групп s
(измеряется кмоль/м2)
связана с межфазным потенциалом
![]() уравнением Гуи – Чепмена
уравнением Гуи – Чепмена
![]()
где
R- газовая постоянная, NА-
число Авогадро, F- число Фарадея, С-
молярная концентрация одновалентного
электролита в среде (KСl или NaCl), e-
относительная диэлектрическая
проницаемость, `j-
потенциал в безразмерной форме (![]() ).
Естественно, что заряд на БМ из электролита
притягивает ионы противоположного
знака, что приводит к образованию ДЭС.
).
Естественно, что заряд на БМ из электролита
притягивает ионы противоположного
знака, что приводит к образованию ДЭС.

Рис.5. Комплексы молекул: (1)- отдельные молекулы фосфолипидов, (2)- элементы БМ,
(3)- липосома, (4)- мицелла.
В реально функционирующей БМ существует ассиметрия распределения ионов внутренней среды за счет активного и пассивного транспорта ионов и картина выглядит значительно сложней. В простейшем случае распределение потенциалов вблизи мембраны по обе стороны от нее имеет вид рис.6., т.е. для БМ характерны скачки потенциалов, причем по мере удаления от границы раздела потенциал уменьшается по экспоненте
![]()
где
x- координата точки пространства, а LD-
радиус экранировки Дебая. Последняя
величина характеризует толщину двойного
электрического слоя ионов у границы
раздела и зависит от суммарной концентрации
ионов в среде и их заряда![]() ,
а также от относительной диэлектрической
проницаемости среды e,
т.е.
,
а также от относительной диэлектрической
проницаемости среды e,
т.е.
 .
.
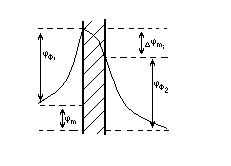
На рис.6. jф1 и jф2 межфазные скачки потенциалов у двух поверхностей БМ (наружной и внутренней), jm- разность потенциалов между водными фазами по обе стороны мембраны, Djmi- падение напряжения внутри мембраны. Последняя величина обеспечивает перенос ионов через мембрану.
М
Рис.6. Распределение потенциалов вблизи мембраны М
Таким образом, возникающий в биологических объектах и в любых других дисперсных системах Д.Э.С. приводит к возникновению потенциала на поверхности раздела фаз - x-потенциала, который можно зарегистрировать и величина его будет зависеть как от свойств среды, так и от функционального состояния биологических объектов.
В данной работе определяется величина x- потенциала дрожжевых клеток имеющих сферическую форму, движущихся под действием внешнего электрического поля (электрофорез).
Расчетную формулу для движения сферической заряженной частицы радиусом r в электрическом поле с напряженностью Е можно получить следующим образом. Пусть сферическая частица с зарядом q движется в вязкой среде, тогда на нее действует две силы: сила Кулона Fk=qE и сила вязкостного трения, которая по формуле Стокса Fтр=6phrv, где h- коэффициент вязкости (для воды h~10-2 пуаз), а v- скорость движения частицы. Если движение установившееся (v=const), то по I закону Ньютона Fk=Fтр или
qE=6phrv (1)
для
заряженной сферы вблизи ее поверхности
потенциал
![]() (в СГС), отсюда
(в СГС), отсюда
q=jer
Þ
qE=jerE=6phrv
Þ
![]() (2)
(2)
Учет некоторых физических особенностей рассматриваемого процесса дает значение
![]() (3)
(3)
где
u-
скорость движения заряженного сфероида
находится опытным путем из значений
пройденного частицей пути S (S=nc,
где n-число делений шкалы окуляр-микроскопа,
а с- цена одного деления) и времени этого
движения t,
т.е. v=S/t.
Зная напряженность электрического поля
Е
находим из формулы связи напряженности
Е
с потенциалом j
![]() ,
или в случае одномерной задачи в скалярном
виде
,
или в случае одномерной задачи в скалярном
виде
Е=![]() (4).
(4).
Разность потенциалов Ñj=U- напряжение между электродами, а х= - расстоянию между электродами. Тогда окончательно величина потенциала на поверхности дрожжевой клетки, которую мы будем называть x- потенциалом определится с учетом (3) и(4) по формуле
![]() (5).
(5).
Подставляя вместо h=10-2 и e=81 для воды p=3,14 и, переводя все единицы измерения в СИ, будем иметь расчетную формулу
![]() (6).
(6).
Иногда
вместо
![]() пишут
пишут
![]() ,
где `v
называется электрофоретической скоростью
или подвижностью. Легко видеть, что
подвижность частицы
,
где `v
называется электрофоретической скоростью
или подвижностью. Легко видеть, что
подвижность частицы
![]() есть отношение ее линейной скорости v
к градиенту потенциала электрического
поля. Поэтому (6) можно записывать в виде
есть отношение ее линейной скорости v
к градиенту потенциала электрического
поля. Поэтому (6) можно записывать в виде
![]() (7).
(7).
Зная
x-потенциал
и радиус частицы можно определить
поверхностную плотность зарядов
![]() ,
где q=jer(СГС),
а S- площадь сфероида (S=4pr2).
Эта величина зависит от свойств
биологической мембраны и может меняться
при изменении функционального состояния
организма (патология) или условий внешней
среды, например, действие радиации.
,
где q=jer(СГС),
а S- площадь сфероида (S=4pr2).
Эта величина зависит от свойств
биологической мембраны и может меняться
при изменении функционального состояния
организма (патология) или условий внешней
среды, например, действие радиации.
ЛАБОРАТОРНАЯ РАБОТА № 1.6
КИНЕТИКА БИОХИМИЧЕСКИХ РЕАКЦИЙ.
ОПРЕДЕЛЕНИЕ СКОРОСТИ И МОЛЕКУЛЯРНОСТИ
РЕАКЦИЙ.
Цель работы:
Обучаемый должен знать:
1.Основные модельные типы химических реакций и методы их изучения.
2. Основные законы химической кинетики.
3. Кинетические допущения в гетерогенных системах.
4. Особенности применения законов кинетики в биологических системах.
Обучаемый должен уметь:
1. Наблюдать за протеканием реакции и обработать кинетические данные для уточнения молекулярности и механизма реакции.
2. Вывести уравнения кинетики модельных реакций.
3. Назвать и обосновать допущения применяемые для гетерогенных систем.
4. Использовать стандартные кинетические методы для конкретных реакций.
