
- •Динамика
- •15. Момент импульса вращающегося тела относительно оси:
- •Основные законы кинематики.
- •1.Уравнение равномерного прямолинейного движения
- •2. Средняя скорость неравномерного прямолинейного движения тела
- •3.Уравнение равнопеременного прямолинейного движения
- •4. Уравнение криволинейного равномерного движения тела.
- •5. Уравнение криволинейного равнопеременного движения тела.
- •Виды сложного движения:
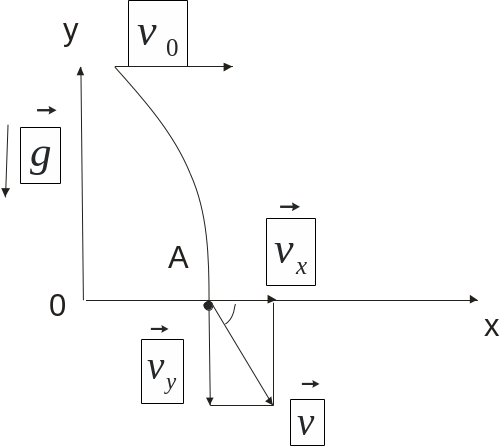
- •1. Движение тела, брошенного под углом к горизонту:
- •2) Уравнение движения тела брошенного горизонтально со скорость с некоторой высоты:
- •Основы молекулярной физики и термодинамики
- •43.Функция распределения молекул по скоростям: - определяет относительное число молекул скорости которых лежат в интервале от до .
- •44. Закон Максвелла о распределении молекул идеального газа по скоростям:
- •Электростатика
- •Постоянный ток.
- •Основные законы сто.
2) Уравнение движения тела брошенного горизонтально со скорость с некоторой высоты:
a) - координата тела в любой момент времени t по оси ОX при движении тела брошенного горизонтально.
б) - координата тела в любой момент времени t по оси ОY.
в)
![]() - скорость в проекциях на ось ОX
при движении тела брошенного
горизонтально с начальной скоростью
с некоторой высоты.
- скорость в проекциях на ось ОX
при движении тела брошенного
горизонтально с начальной скоростью
с некоторой высоты.
г)
![]() ,
- скорость в проекциях на ось ОY
при движении тела брошенного горизонтально
с начальной скоростью
с некоторой высоты.
,
- скорость в проекциях на ось ОY
при движении тела брошенного горизонтально
с начальной скоростью
с некоторой высоты.
д)
![]() - скорость в произвольной точке
траектории
- скорость в произвольной точке
траектории
![]()
3) Движение тела, брошенного вертикально вверх:
a)
![]() - скорость
тела при данном движении
- скорость
тела при данном движении
б)
![]() - высота
подъема тела
- высота
подъема тела
в)
![]()
4) Движение тела при свободном падении:
a)
![]()
б)![]()
в)
![]()
Основы молекулярной физики и термодинамики
1.Количество
вещества
![]() ,
,
где
N – число молекул,
NA – постоянная Авогадро,
m – масса вещества,
M – молярная масса.
2.
Масса вещества:
![]() ,
где
,
где
![]() -
масса одной молекулы
-
масса одной молекулы
3.Уравнение Менделеева- Клайперона
![]() ,
,
![]()
где
р – давление газа,
V – его объем,
R
– молярная газовая постоянная,
![]() ,
,
![]() -
постоянная Больцмана
-
постоянная Больцмана
T – термодинамическая температура.
4.Объединенный
газовый закон (для газа неизменной
массы):
![]() ,
,![]()
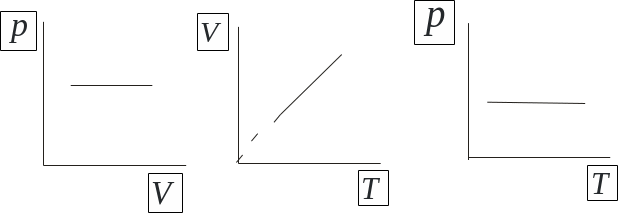
5. Закон Бойля-Мариотта (изотермический процесс):
![]() ;
;
![]() ,
,
![]()

6. Закон Гей-Люссака (изобарный процесс):
![]() ;
;![]() ;
;![]()
7.
Закон Шарля (изохорный процесс):
![]() ;
;![]() ;
;![]()

8.
Закон Дальтона (давление смеси химически
не взаимодействующих газов):
![]() ;
;![]() ,
,
![]() -парциальное
давление,
-количество
газов в смеси.
-парциальное
давление,
-количество
газов в смеси.
9.Основное уравнение молекулярно – кинетической теории газов:
![]() ,
,
![]()
где
![]() – концентрация
молекул,
– концентрация
молекул,
<Eпост> – средняя кинетическая энергия поступательного движения молекул,
m0 – масса молекулы,
<υкв> – средняя квадратичная скорость.
10.Средняя кинетическая энергия теплового движения одной молекулы
![]() ,
или
,
или
![]()
где
i – число степеней свободы,
k – постоянная Больцмана.
11.Внутренняя энергия идеального газа
![]() .
.
12.Скорости молекул:
средняя
квадратичная ![]() ,
,
средняя
арифметическая (средняя скорость
молекулы)
![]() ,
,
наиболее
вероятная ![]() .
.
13. Средняя длина свободного пробега молекулы
![]() ;
;![]() ,
,
где d – эффективный диаметр молекулы.
14.Среднее число столкновений молекулы в единицу времени
![]() .
.
15.Уравнение диффузии
![]() ,
,
где
D – коэффициент диффузии,
Ρ – плотность,
dS – элементарная площадка, перпендикулярная к оси Х.
16.Уравнение теплопроводности
![]() ,
,
где χ – коэффициент теплопроводности.
17.Сила внутреннего
трения
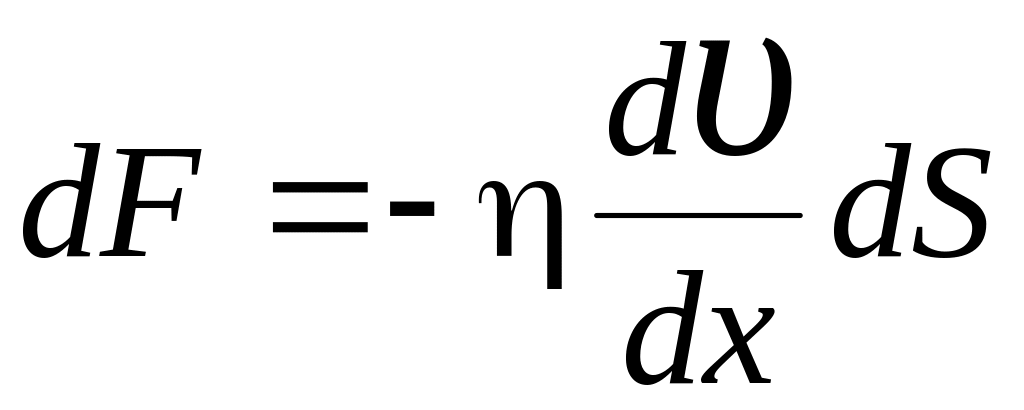 ,
,
где η – динамическая вязкость.
18.Коэффициент
диффузии ![]() .
.
19. Вязкость
(динамическая)
![]() .
.
20.Теплопроводность
![]() ,
где сV
- удельная
изохорная теплоемкость.
,
где сV
- удельная
изохорная теплоемкость.
21.Молярная теплоемкость идеального газа:
Изохорная ![]() ,
,
Изобарная ![]() .
.
22.Первое начало термодинамики
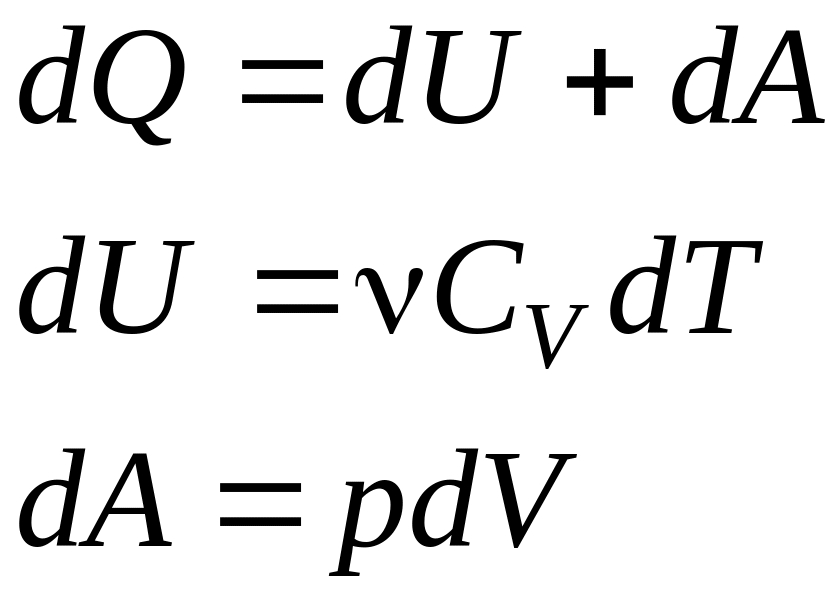
23.Работа расширения газа при процессе:
Изобарном ![]() ,
,
Изотермическом ![]() ,
,
Адиабатном
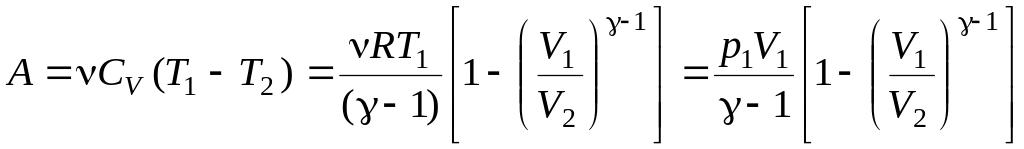 ,
где
,
где ![]() .
.
24. Уравнение Пуассона (уравнение адиабатного процесса)
![]() ,
,
![]() ,
,
![]() .
.
25. Коэффициент полезного действия цикла Карно
![]() ,
где
,
где
Q и T – количество теплоты, полученное от нагревателя, и его температура,
Q0 и T0 – количество теплоты, переданное холодильнику, и его температура.
26. Изменение энтропии при переходе из состояния 1 в состояние 2
![]()
27.Уравнение Ван - дер - Ваальса:
для 1 моль газа
![]() ,
,
для ν
моль газа
![]() ,
,
где a и b – постоянные Ван - дер – Вальса, VM – объем 1 литра газа.
28.Критические
параметры
![]() .
.
29. Собственный
объем молекулы
![]() ,
,
![]() -
собственный объем всех молекул.
-
собственный объем всех молекул.
30.Высота поднятия жидкости в капилляре радиусом r
![]()
31. Связь между молярной (Cm) и удельной (с) теплоемкостями газа
Cm=cM, где М — молярная масса газа.
32. Молярные теплоемкости* при постоянном объеме и постоянном давлении соответственно равны
Cv=iR/2; Cp=(i+2)R/2
где i — число степеней свободы; R — молярная газовая постоянная.
33. Удельные теплоемкости при постоянной объеме и постоянном давлении соответственно равны
![]() ,
,
![]() .
.
34. Уравнение Майера
Cр—Сv=R.
35. Показатель адиабаты
![]() ,
или
,
или
![]() ,
или
,
или
![]() .
.
36. Внутренняя энергия идеального газа
U=N<>
или U=vCvT,
или
![]()
где <>—средняя кинетическая энергия молекулы; N—число молекул газа; v — количество вещества.
37. Работа, связанная с изменением объема газа, в общем случае вычисляется по формуле
 ,
,
где V1 — начальный объем газа; V2 — его конечный объем.
Работа газа:
а) при изобарном процессе (p=const)
A=p(V2 - V1);
б) при изотермическом процессе (T=const)
![]() ;
;
в) при адиабатном процессе
![]() ,
или
,
или
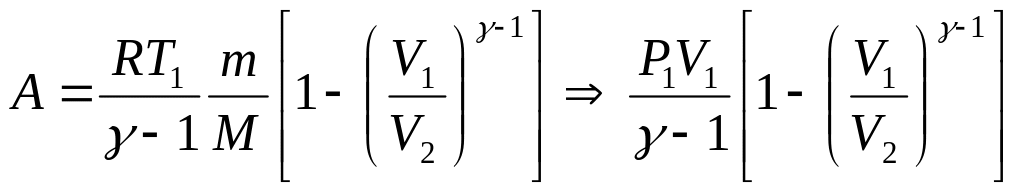 ,
,
где T1 — начальная температура газа; T2 — его конечная температура.
38. Уравнение
политропы :![]() ,
,![]() ,
,
41.Связь между начальным и конечным значениями параметров состояний газа при адиабатном процессе:
![]() .
.
39. Первое начало термодинамики в общем случае записывается в виде
![]() ,
,
![]()
где Q – количество теплоты, сообщённое газу; U—изменение его внутренней энергии; А — работа, совершаемая газом против внешних сил.
Первое начало термодинамики:
а) при изотермическом
процессе
![]() ,
(U=0,
,
(U=0,
![]() ,
,![]() ,
,
![]() ,
,
![]() ).
).
![]() ,
,
б) при изобарном
процессе![]() ,
(
,
(![]() ,
,
![]() ,
,
,
).
,
,
,
).
![]()
в) при изохорном
процессе
![]() ,(A=0,
,(A=0,
![]() ,
,
,
,
,
,![]() )
)
![]() ;
;
г) при адиабатном
процессе (![]() ,
,
![]() )
)
![]() .
.
40. Изменение энтропии
![]()
где A и B — пределы интегрирования, соответствующие начальному и конечному состояниям системы. Так как процесс равновесный, то интегрирование проводится по любому пути.
41. Формула Больцмана
S=klnW,
где S — энтропия системы; W — термодинамическая вероятность ее состояния; k — постоянная Больцмана.
Барометрическая формула (распределение давления в однородном поле силы тяжести):
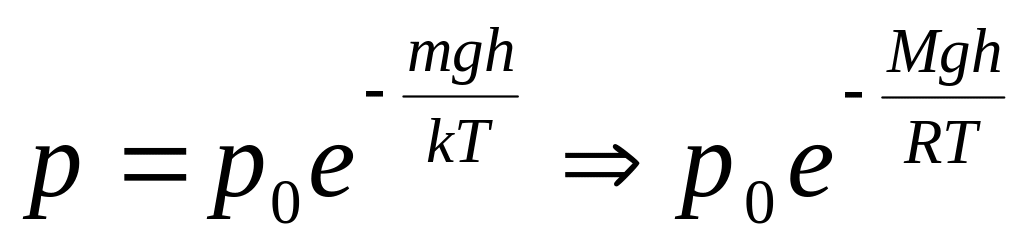 ,
где
,
где -давление
газа ,
-давление
газа ,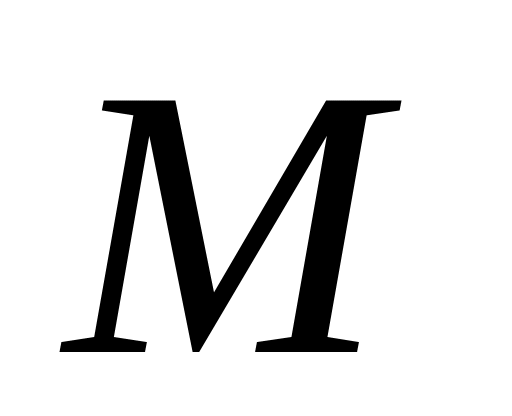 -
молярная масса,
-
молярная масса,
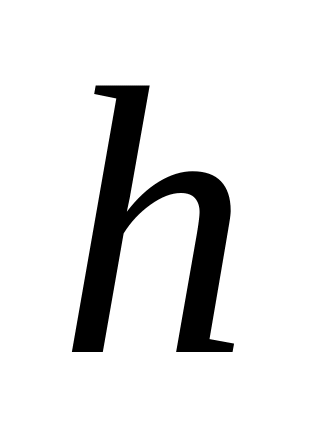 - координата (высота) точки по отношению
к уровню, принятому за нулевой,
- масса частицы,
- координата (высота) точки по отношению
к уровню, принятому за нулевой,
- масса частицы,
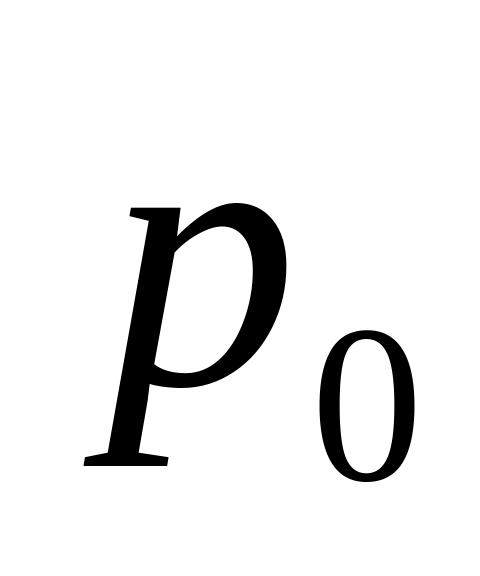 - давление на этом уровне
- давление на этом уровне
- ускорение свободного
падения,
![]() - универсальная газовая постоянная
- универсальная газовая постоянная
