
- •Г л а в а 1. Основные характеристики биосферы
- •1.1.Иерархическая структура биосферы
- •1.2. Вещественный состав среды обитания
- •Химический состав и классификации природных вод
- •1.3. Химические элементы в организмах
- •Общие закономерности химической дифференциации живого вещества в биосфере
- •1.4. Биосфера как сложная адаптивная система
- •1.4.1 Особенности термодинамической системы биосфера
- •1.4.2. Принцип Ле-Шателье - Брауна
- •Г л а в а 2. Организация живой материи
- •2.1. Упрощенная схема организации живой материи
- •2.2. Основные типы организмов
- •Автотрофы
- •Гетеротрофы
- •Анаэробы
- •Фенотип вида
- •2.3. Популяция
- •2.4. Экосистема
- •2.4.1. Экосистемная организация жизни
- •2.4.2. Размеры и биоразнообразие экосистем
- •2.4.3. Поведение экосистем
- •2.4.4. Важнейшие принципы строения биосферы
- •2.5. Факторы, определяющие состав и структуру экосистем
- •2.5.1. Энергетические факторы
- •Правило одного процента
- •Правило десяти процентов или закон пирамиды энергий р.Линдемана
- •Доля энергии, поступающей из биосферы в литосферу
- •2.5.2. Абиотические факторы
- •2.5.3. Биотические факторы
- •2.6. Действие экологических факторов на экосистемы
- •2.6.1. Показатели состояния экосистемы
- •2.6.2. Экологические риски
- •Вероятность неблагоприятного воздействия
- •Вероятность поражения объектов
- •Оценка экологического риска
- •2.6.3. Балльные оценки
- •Примерная шкала оценки состояния экосистемы
- •Г л а в а 3. Биогеохимические циклы
- •3.1. Общая характеристика циклов экосистем
- •Сопряжение биогеохимического цикла углерода с циклами других биогенов
- •3.2. Цикл углерода
- •Геологический кругооборот углерода
- •Накопление углерода в осадочных породах и процессы рифтогенеза
- •Биогеохимический цикл углерода
- •Антропогенное воздействие на круговорот углерода и его последствия
- •3.3. Биогеохимический цикл кислорода
- •Его расхода на окислительные процессы за неогей (1,6 млрд лет)
- •3.4. Биогеохимический цикл азота
- •3.5. Биогеохимический цикл фосфора
- •3.6. Биогеохимический цикл серы
- •3.7. Биогеохимический цикл железа
- •Г л а в а 4. Возникновение и эволюция жизни на Земле
- •4.1. Химическая эволюция
- •4.2. Сценарий образования и эволюции жизни на Земле
- •4.3. Закономерности эволюции биоты
- •Примеры наиболее ярких кризисов.
- •5.4. Эволюция человека
- •Г л а в а 5. Коэволюция биосферы и геосферных оболочек
- •Планета Земля
- •5.1. Начальный этап развития Земли (4,6‑4,0 млрд лет назад)
- •5.2. Особенности геологической истории
- •5.2.1. Докембрийский период
- •Ранний архей. Возникновение протоконтинентальной коры (4,0‑3,15 млрд лет)
- •Поздний архей. Формирование континентальной коры (3,15 – 2,50 млрд лет)
- •Ранний протерозой. Распад Пангеи (2,5‑1,7 млрд лет)
- •Нижний и средний рифей. Восстановление единства Пангеи (1,7—1,0 млрд лет)
- •Поздний протерозой. Раскол суперматерика Пангея (1,00 – 0,57 млрд лет)
- •Связь массовых вымираний с процессами рифтогенеза
- •Древнейшие экосистемы
- •5.2.2. Фанерозой
- •Палеозойская эра
- •Мезозойская эра
- •Кайнозойская эра
- •Г л а в а 6. Последствия антропогенного влияния на геосферы
- •6.1. Глобальные последствия загрязнения атмосферы
- •6.1.1 Санитарно-гигиеническая оценка качества атмосферного воздуха
- •Характеристики уровня загрязнения атмосферы
- •Критерии суммарного загрязнения атмосферы
- •6.1.2. Кислотные дожди
- •Источники поступления оксидов серы
- •Источники поступления оксидов азота
- •Механизм образования кислотных осадков
- •Воздействие кислотных дождей на экосистемы и людей
- •Меры по защите окружающей среды от кислотных дождей
- •Кислотообразующие выбросы мегаполисов
- •6.1.3. Озоновые дыры
- •Механизмы разрушения озонового слоя
- •Особенности формирования озоновых дыр в полярных областях
- •6.1.4. Изменение климата
- •Факторы, определяющие климат Земли
- •Особенности орбитального движения Земли
- •Солнечная энергия
- •Вулканы
- •Природные факторы, влияющие на климат Земли
- •Система ветров
- •Морские течения
- •Тектоника плит
- •Парниковый эффект и аэрозоли
- •Основные тенденции изменения климата в истории Земли
- •Общая характеристика последствий изменений климата
- •Факторы изменения климата, не связанные с антропогенным влиянием
- •Международная политика и глобальное потепление
- •6.2. Загрязнение гидросферы
- •6.2.1. Санитарно-гигиенические критерии оценки качества вод
- •6.2.2. Загрязнение морей нефтью и нефтепродуктами
- •Состав нефтепродуктов и их поведение в водоемах
- •Индексы чувствительности побережья к нефтяному загрязнению
- •Охрана морей и океанов
- •6.2.3.Загрязнение внутренних водоемов при добыче нефти
- •Характеристика источников воздействия на окружающую среду
- •Анализ состояния водотоков бассейна реки Ватинский Ёган
- •Динамика загрязнения нефтепродуктами и хлоридами
- •6.2.4 Загрязнение внутренних водоемов
- •Эвтрофикация и механизм ее воздействия на экосистемы водоемов
- •Оценка степени эвтрофикации
- •Предупреждение эвтрофикации
- •Примеры решения проблем реабилитации внутренних водоемов
- •Великие озёра Северной Америки
- •Экологические проблемы Ладожского озера
- •6.3. Антропогенное влияние на литосферу
- •6.3.1. Химическое и биологическое загрязнение почв и грунтов
- •Санитарно-гигиеническая оценка опасности химического загрязнения почв
- •Общая характеристика опасности химического загрязнения
- •Тяжелые металлы
- •Пестициды.
- •Природный геохимический фон – биогеохимические провинции
- •6.3.2. Экологические проблемы городов
- •Поступление веществ в город
- •Состояние воздушного бассейна
- •Загрязнение водного бассейна
- •Твердые и концентрированные отходы
- •Биогеохимические процессы на полигонах тбо и их использование
- •Полигон тбо, как источник метана
- •6.3.3. Техногенное изменение литосферы в городах (на примере Москвы)
- •Геологическая среда территории Москвы
- •На территории Москвы Влияние хозяйственной деятельности на гидрогеологические условия
- •6.3.4. Воздействие на окружающую среду разработки месторождений полезных ископаемых
- •Эколого-геологические условия и ресурсы района оз. Баскунчак
- •Экологические неблагоприятные процессы, обусловленные добычей солей и гипса
- •И уровень соляного пласта (левая шкала, м абс. Отм.).
- •Рекомендации по рациональному освоению ресурсов
- •6.3.5. Радиационная безопасность
- •Характеристики величин и единиц в области ионизирующих излучений
- •Воздействие излучения на человека
- •Основные принципы нормирования дозовых нагрузок
- •Радиоактивность окружающей среды. Источники радиоактивного облучения
- •Месторождения полезных ископаемых, как источник радиоактивного загрязнения
- •Атомная энергетика и радиационная безопасность
- •Радиационная обстановка в районах ядерных взрывов и аварий
- •Облучение от источников, применяемых в медицине
- •Последствия ядерных аварий
- •Южно-Уральский след
- •Авария на Чернобыльской атомной электростанции
- •Результаты радиационно-гигиенической паспортизации опасных объектов
Химический состав и классификации природных вод
По мнению А.П. Виноградова, химический состав океанической воды определяется сохранением в растворе высоко растворимых и выпадением трудно растворимых соединений. Средняя соленость Мирового океана принята равной 350/00. Солевая масса океана, составляющая 56 1015 т, практически инертна и для ее изменения необходимы миллионы лет. В океанической воде обнаружены почти все элементы Периодической системы. Главные компоненты (г/кг): Cl– – 19,3; SO42– – 2,71; HCO3– – 0,14; Ca2+ – 0,41; Na+ – 10,8; K+ – 0,39. Постоянство объема океана поддерживается круговоротом вод, включающим испарение, выпадение осадков и сток. Однако содержания отдельных компонентов может меняться при нарушении баланса их поступления и выноса. Существует зональность в вещественном составе вод, связанная с изменение их температуры. Для теплых морей характерно, например, повышенное содержание кальция, влияющее на распространение жизни. Акватория открытых вод Мирового океана бедна веществами, необходимыми для биоты.
Поверхностные воды суши представляют наиболее подвижную часть гидросферы. В процессе стока они растворяют или захватывают частицы минерального вещества, меняя химический состав. Для наглядного изображения химического состава вод обычно используется формула Курлова. Она представляет собой псевдодробь, в числителе которой слева направо записываются анионы (в процентах количества вещества, выраженного в эквивалентах) в порядке убывания. В знаменателе таким же способом записываются катионы. Количество катионов и анионов округляется до целых чисел. Ионы, количество которых меньше 10 экв% (сумма катионов и анионов принимается раздельно за 100 экв%), формулой не учитываются. Слева от дроби записывают величину общей минерализации или сухой осадок (г/л или г/кг воды) и экологически значимых компонентов (в мг/л). Справа от дроби указывают температуру воды (в 0С), величину расхода или дебита (в л/с или м3/сут) источников, рН и т.д. Например, состав воды водного объекта по формуле Курлова может быть представлен в следующем виде:
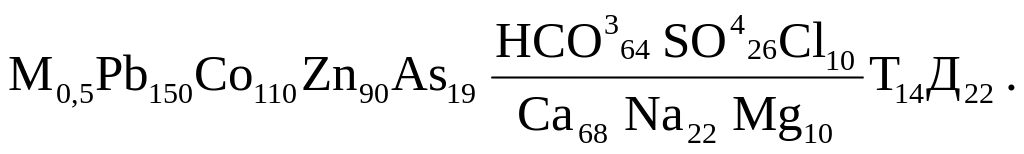
Для подземных вод характерна определенная зональность в плане и разрезе.
Широтная зональность присуща грунтовым и неглубоко залегающим напорным водам. Их состав меняется с севера на юг от ультрапресных гидрокарбонатных (с кремнекислотой) через пресные гидрокарбонатные на соленые сульфатные и хлоридные. Гидрокарбонатные воды формируется в областях с повышенными атмосферными осадками или в районах недостаточно увлажненных, но с хорошо проницаемыми породами. Сульфатные и хлоридные – на равнинах сухих степей, полупустынь и пустынь. Средний химический состав грунтовых вод зон выщелачивания и континентального засоления по С. Л. Шварцеву следующий:
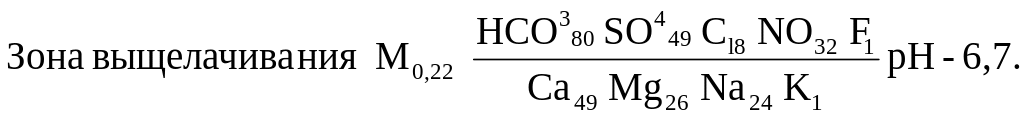
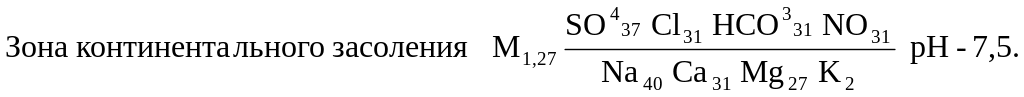
Зональность подземных вод в вертикальном разрезе определяет повышение их минерализации с глубиной и состава по схеме:
![]()
Обратная зональность (гидрохимическая инверсия) наблюдаться при наличии отложений легкорастворимых минеральных солей. (В.В.Куриленко, 1997).
Химические классификации вод основаны на выделении либо преобладающих, либо специфических составляющих солевого состава.
Классификация природных вод, основанная на преобладающих составляющих, может исходить из количества растворенных веществ (общей минерализации, сухого остатка или удельного веса). По величине минерализации (г/л) выделяют очень пресные – <0,1; пресные – 0,1-0,5; жесткие пресные – 0,5-1,0; соленые – 1-35 (солоноватые – 1,0-3,0; слабосолоноватые – 3,0-10,0; среднесоленые - 10,0-18,0; сильносоленые – 18,0-35,0); рассольные – >35.
Общая минерализация представляет сумму минеральных веществ. Сухой остаток получают путем выпаривания определенного объема (навески) воды остатка (если вода имеет повышенную минерализацию и в ней присутствуют сульфатные и хлоридные соли кальция и магния, сухой остаток определяют с добавкой соды или фторида натрия, чтобы предотвратить образование кристаллогидратов, основных солей и поглощение влаги при высушивании сухого остатка). Приближенное значение величины минерализации дает удельный вес воды. Общую минерализацию и сухой остаток выражают для пресных и солоноватых вод в граммах на 1 л, для рассолов или в граммах на 1 л, или в граммах на 1 кг (промилле, %о). Пресной называется вода, имеющая минерализацию ниже 1 г/л (1 промилле).
Согласно классификации (Н.С. Курнакова – М.Г. Валяшко) выделяются карбонатный, сульфатный, хлоридный типы вод, соответствующие закономерным изменениям растворимости соединений макрокомпонентов. Основными свойствами выделенных типов вод является то, что переход состава воды из одного химического типа в другой не может быть осуществлен иначе, как путем взаимодействия с веществом природной среды. Эти взаимодействия получили название процессов метаморфизации природных вод. При этом различают прямую и обратную метаморфизации. Преобразование в прямом направлении приводит к постепенной потере менее устойчивых в растворе компонентов и переходу химических типов в направлении, от карбонатного к хлоридному через сульфатный тип вод. Обратная метаморфизация приводит к смене хлоридных вод сульфатными и карбонатными.
Развитию прямой метаморфизации способствует увеличение аридности климата, возрастание подвижности иона кальция, что приводит к росту общей минерализации воды и ее сульфатности и хлоридности. Процесс обратной метаморфизации определяет наличие влажного климата, что вызывает рассоление водовмещающих пород, снижение степени минерализации взаимодействующих с ними вод и возрастание их карбонатности.
Карбонатный тип вод характеризуется присутствием макрокомпонентов лишь в пределах растворимости их карбонатов.
Сульфатный тип воды определяется присутствием макрокомпонентов в пределах растворимости сульфата; карбонат- и бикарбонат-ионы – в пределах растворимости их кальциевых и магниевых солей. В этом типе выделяются два подтипа: сульфатно-натриевый и хлоридно-магниевый (сульфатно-магниевый). По относительному содержанию карбонат- и бикарбонат-ионов в сравнении с ионами Ca2+ и Mg2+ каждый из подтипов может быть разделен на две группы.
Хлоридный тип воды отвечает присутствию макрокомпонентов в пределах растворимости кальциевой соли, карбонат- и бикарбонат-ионы – в пределах растворимости их кальциевых и магниевых соединений. Общепризнанной классификаций загрязненных вод в настоящее время не существует. Однако их химических свойств определяется через Eh-pH показатели.
Соотношение солевых составов вод в пределах основных гидрохимических типов согласно классификации Курнакова-Валяшко приведено на рис. 3.
Так. С.Р. Крайнов и В.М. Швец (1992) различают два типа загрязняющих веществ.
инертные, которые не изменяют Еh-рН вод и слабо участвует в реакциях (процессах) комплексообразования;
активные, которые способствуют изменению Еh-рН вод и концентрацию комплексообразующих неорганических и органических веществ.
Например, высокие концентрации Н+, Fе3+ и других элементов в окисленной форме определяют снижение значений рН и повышение Еh, что способствует, в свою очередь, растворению горных пород и донных отложений, а следовательно повышению в воде концентраций химических элементов (Fе, Мn, Zn, Рb, Сu, F, Мо, Тi, Аl и др.). Наоборот, высокие концентрации в воде NНз способствуют повышению рН (NНз++Н20=NН4++ОН-) и снижению Еh. В таких щелочных водах при взаимодействии с породами увеличиваются концентраций многих анионогенных элементов (F, Мо, Аs, Nb и др.).
При этом выделяют следующие гидрохимические типы:
кислые воды с высокими значениями Eh;
околонейтральные воды с высокими значениями Eh;
щелочные воды с низкими положительными значениями Eh;
околонейтральные бескислородные бессульфатные воды с низкими положительными значениями Eh;
околонейтральные и щелочные воды с отрицательными значениями Eh.
Следовательно, химический состав загрязненных вод определяется разнообразием ситуаций, связанных со значениями Eh-pH показателей.
|
|
Карбонатный тип |
|
Сульфатный тип |
|
Хлоридный тип |
|
|
|
|||||||||||||||||||||||
|
|
HCO3(CO3) |
|
SO4 |
|
Cl |
|
|
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
HCO3(CO3) |
SO4 |
Cl |
|
HCO3 |
SO4 |
Cl |
|
HCO3 |
SO4 |
Cl |
|
|
|
|||||||||||||||||
|
|
Ca |
Mg |
Na |
|
|
Mg |
Na |
|
Ca |
Mg |
Na |
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
SO4 - Na |
|
|
|
|
|
|
|
|
|
|
|
Cl - Mg |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
подтип |
|
|
|
|
|
|
|
|
|
|
|
подтип |
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
HCO3 |
SO4 |
Cl |
|
|
|
|
|
HCO3 |
SO4 |
Cl |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
Na |
|
|
|
|
|
|
|
Na |
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Группа |
|
|
|
|
|
|
группа |
|
группа |
|
|
|
|
|
группа |
|||||||||||||||||
HCO3 - Mg |
|
|
|
|
|
|
|
SO4-Ca |
|
HCO3-Mg |
|
|
|
|
|
SO4 - Ca |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
HCO3 |
SO4 |
Cl |
|
HCO3 |
SO4 |
Cl |
|
HCO3 |
SO4 |
Cl |
|
HCO3 |
SO4 |
Cl |
||||||||||||||||||
Ca |
Mg |
Na |
|
Ca |
Mg |
Na |
|
Ca |
Mg |
Na |
|
Ca |
Mg |
Na |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
SO4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
Mg |
|
- специфический компонент |
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
Рис. 3. Классификация химического состава природных вод по Курнакову – Валяшко (Куриленко В. В., 1997)
Атмосфера. Ее масса около 5,2·1015 т (Г. В. Войткович, 1986). В атмосфере выделяют:
тропосферу – достигает высоты 18 км на экваторе и до 8-10 км на полюсах;
стратосферу – простирается на высоту до 50–55 км;
мезосферу – распространяется до 80 км;
ионосферу (термосфера) – высота верхней границы области ионизации около 800 км;
экзосферу – на высоте порядка 2000 км переходит в межзвездную среду.
Биосфера расположена в первом от поверхности Земли слое – тропосфере. Ее верхняя граница − тропопауза – определяется температурой, исчезновения паров воды. 80% массы воздуха сосредоточено в тропосфере. Его состав определяют: азот ~78, кислород ~21 и аргон около ~1%. Газы, которые постоянно присутствуют в атмосфере в небольших концентрациях, принято называть малыми. К ним относят двуокись углерода (CO2), окись углерода (CO), гелий (He), неон (Ne), ксенон (Xe), радон (Rn), криптон (Kr), аммиак (NH3), водород. Содержание CO2, необходимого растениям, в настоящее время составляет около 0,04%. Следует отметить, что состав воздуха меняется с высотой.
Для жизни на суше важен озоновый слой (озон – молекула кислорода, состоящая из трех атомов). Он расположенный в верхних слоях тропосферы и защищает биоту от губительного ультрафиолетового излучения.
Кроме перечисленных газов, в воздухе содержатся вещества природного и антропогенного происхождения, качественный и количественный состав которых меняется: пары воды, пыль, аэрозоли.



 Ca
Ca



 Ca
Ca Mg
Mg
 Ca
Ca Mg
Mg