
- •1.Колебания. Диф. Ур. Колебаний : пружинный и физический маятник, колебательный контур. Решение уравнения. Фаза, период и частота колебаний.
- •2. Сложение колебаний одного направления. Биения
- •3.Сложение взаимно перпендикулярных колебаний. Эллиптическая, круговая и линейная поляризация результирующих колебаний. Фигуры Лиссажу.
- •4.Затухающие колебания. Уравнение, график. Логарифмический декремент и добротность колебательных систем.
- •5.Вынужденные колебания. Резонанс
- •6.Общая характеристика волновых процессов. Продольные и поперечные волны. Фазовая скорость. Уравнение волны. Принцип суперпозиции волн. Групповая скорость.
- •7.Интерференция волн. Стоячая волна. Эффект Доплера.
- •8.Волновое уравнение( с выводом на выбор – в струне, звук в трубе; электромагнитной волны – из уравнений Максвелла)
- •9.Свойства эмв(по шкале). Энергия эмв. Вектор Пойнтинга.
- •10. Интерферанция света. Опыт Юнга. Интенферанция света в тонких пленках. Кольнца Ньютона.
- •Интерференция света в тонких плёнках
- •Кольца Ньютона
- •11. Понятие о дифракции. Принцип Гюйгенса-Френеля. Метод зон френеля.
- •12. Дифракция Фраунгофера. Дифракция на пространственной (кристалической) решеткн. Формула Вульфа Брэггов. Понятие о голографии.
- •Математическоe описание
- •13. Взаимодеействие света с веществом (поглащение, рассеяние и дипрессия).
- •14. Поляризация света. Двойное лучеприломление. Закон Брюстера. Вращение плоскости поляризации.
- •15. Тепловое излучение и его характеристики. Законы Кирхгофа, Стефана-Больцмана и Вина. «Ультрафиолетовая катастрофа». Квантовая гипотеза и формула Планка.
- •16. Внешний фотоэффект и его законы. Корпускулярно-волновая двойственность свойств света. Масса и импульс фотона. Давление света.
- •17. Эффект Комптона.
- •18. Корпуксолярно-волновая двойственность свойств частиц вещества. Волны де Бройля. Волновая функция, ее свойства и статический смысл.
- •Волны де бройля
- •Волновая функция
- •19. Соотношение неопределенностей Гейзенберга. Уравнение Шредингера. Движение свободной частицы. Движение частицы в одномерной потенциальной яме.
- •20. Прохождение частицы через потенциальный барьер. Туннельный эффект.
- •21. Квантовый гармонический асцилятор.
- •23. Постулаты Бора. Опыты Франка и Герца. Спектр атома водорода по Бору.
- •24. Атом водорода в квантовой механике. Квантовые числа как результат решения уравнения Шредингера. Правила отбора.
- •25.Принцип Паули. Периодическая таблица элементов д.И. Менделеева. Химические связи и энергетические уровни в молекулах, строение молекул.
- •26.Отрицательное поглощение света. Лазеры.
- •27. Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа. Уравнение состояния идеального газа. Основные газовые законы.
- •28. Функция распределения молекул по модулю скорости. Распределение Максвелла и его экспериментальное подтверждение. Средние скорости молекул.
- •29. Идеальный газ в поле тяготения. Барометрическая формула. Распределение Больцмана для частиц во внешнем потенциальном поле и его экспериментальное подтверждение.
- •30. Длина свободного пробега молекул. Броуновское движение.
- •31 Краткая характеристика явлений переноса: диффузия, вязкость, теплопроводность.
- •32 Внутренняя энергия системы. Внутренняя энергия идеального газа. Теплопередача и количество теплоты. Теплоемкость. Работа в термодинамике. Первое начало термодинамики.
- •33 Применение первого начала термодинамики к анализу изопроцессов в идеальном газе. Адиабатический процесс.
- •35 Второе начало термодинамики, его различные формулировки.
- •36 *Тепловые и холодильные машины, схема их устройства. Цикл Карно, теоремы Карно.
- •37 Реальные газы. Уравнение Ван-Дер-Ваальса. Изотермы реальных газов.
- •38 *Строение кристаллических тел, их разновидности и свойства
- •39 Строение жидкостей. *Поверхностное натяжение. *Капиллярные явления
- •40. Понятие о зонной теории твердых тел. Металлы, полупроводники и диэлектрики.
- •41 Модели строения и основные свойства ядер
- •42. Энергия связи, дефект массы. Ядерные силы. Масс-спектрометры и определение масс ядер.
- •43. Явление радиоктивности. Альфа- и бета-распад. Ядерные реакции деления и синтеза. Классификация элементарных частиц. Кварковая гипотеза
- •44.Фундаментальные взаимодействия. Основные положения современной физической картины мира.
37 Реальные газы. Уравнение Ван-Дер-Ваальса. Изотермы реальных газов.
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева.
Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём. Состояние реального газа часто на практике описывается обобщённым уравнением Менделеева — Клапейрона:
![]()
Уравнение Ван-Дер-Ваальса Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:
![]()
Вывод уравнения:
![]()
![]()
![]()
![]()
Изотермы реальных газов
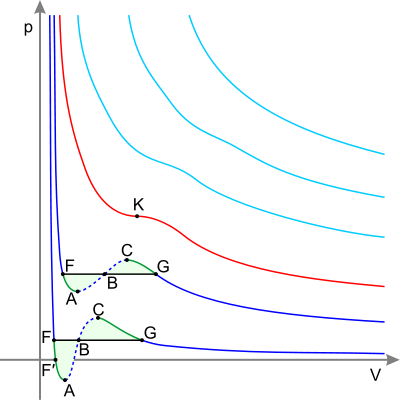
Синие — изотермы при температуре ниже критической. Зелёные участки на них — метастабильные состояния. Участок левее точки F — нормальная жидкость. Точка F — точка кипения. Прямая FG — равновесие жидкой и газообразной фазы. Участок FA — перегретая жидкость. Участок F′A — растянутая жидкость (p<0). Участок AC — аналитическое продолжение изотермы, физически невозможен. Участок CG — переохлаждённый пар. Точка G — точка росы. Участок правее точки G — нормальный газ. Площади фигуры FAB и GCB равны. Красная — критическая изотерма. K — критическая точка. Голубые — сверхкритические изотермы
38 *Строение кристаллических тел, их разновидности и свойства
Строение кристаллических тел - твёрдые тела, в которых атомырасположены закономерно, образуя трёхмерно-периодическую пространственную укладку — кристаллическую решётку. Ионная решётка — состоит из ионов противоположного знака, которые чередуются в узлах. Вещества с таким типом решётки обладают высокой температурой плавления. Ионные кристаллы, например, соль, обычно являются диэлектриками.
Атомная решётка — состоит из атомов, связанных ковалентной или металлической связью. Характерна для алмаза и металлов. Вещества с ковалентной решёткой характеризуются высокой твердостью, а с металлической — пластичностью. Металлическая связь предполагает также высокую электропроводность (из-за ее делокализованности), а ковалентная — в зависимости от ширина ширины запрещенной зоны делает кристалл либо диэлектриком, либо полупроводником.
Молекулярная решётка — узлы образуют молекулы. Вещества с таким типом решетки летучи, легкоплавки, обладают низкой твердостью, обычно являютсядиэлектриками.
39 Строение жидкостей. *Поверхностное натяжение. *Капиллярные явления
Жидкое состояние, занимая промежуточное положение между газами и кристаллами, сочетает в себе некоторые черты обоих этих состояний. В частности, для жидкостей, как и для кристаллических тел, характерно наличие определенного объема, и вместе с тем жидкость, подобно газу, принимает форму того сосуда, в котором она находится. Далее, для кристаллического состояния характерно упорядоченное расположение частиц (атомов или молекул), в газах в этом смысле царит полный хаос. Согласно рентгенографическим исследованиям, в отношении характера расположения частиц жидкости также занимают промежуточное положение. В расположении частиц жидкости наблюдается так называемый ближний порядок. Это означает, что по отношению к любой частице расположение ближайших к ней соседей является упорядоченным. Однако по мере удаления от данной частицы расположение по отношению к ней других частиц становится все менее упорядоченным, и довольно быстро порядок в расположении частиц полностью исчезает. В кристаллах имеет место дальний порядок: упорядоченное расположение частиц по отношению к любой частице наблюдается в пределах значительного объема.
Пове́рхностное натяже́ние — термодинамическая характеристика поверхности раздела двух находящихся в равновесии фаз, определяемая работой обратимого изотермокинетического образования единицы площади этой поверхности раздела при условии, что температура, объём системы и химические потенциалы всех компонентов в обеих фазах остаются постоянными.
Поверхностное натяжение имеет двойной физический смысл — энергетический (термодинамический) и силовой (механический). Энергетическое (термодинамическое) определение: поверхностное натяжение — это удельная работа увеличения поверхности при её растяжении при условии постоянства температуры. Силовое (механическое) определение: поверхностное натяжение — это сила, действующая на единицу длины линии, которая ограничивает поверхность жидкости[1].
КАПИЛЛЯРНЫЕ ЯВЛЕНИЯ - совокупность явлений, обусловленных действием межфазного поверхностного натяжения на границе раздела несмешивающихся сред; к К. я. обычно относят явления в жидкостях, вызванные искривлением их поверхности, граничащей с др. жидкостью, газом или собств. паром. К. я.- частный случай поверхностных явлений. В отсутствие силы тяжести поверхность жидкости искривлена всегда. Под воздействием поверхностного натяжения ограниченный объём жидкости стремится принять форму шара, т. е. занять объём с мин. поверхностью. Силы тяжести существенно меняют картину. Жидкость с относительно малой вязкостью быстро принимает форму сосуда, в к-рый налита, причём её свободная поверхность (не граничащая со стенками сосуда) в случае достаточно больших масс жидкости и большой площади свободной поверхности практически плоская.
