
- •Раздел 2. Строение вещества
- •2.1 Строение атома и периодическая система элементов
- •Квантовые числа
- •Принципы распределения электронов в атоме
- •Электронные формулы и энергетические ячейки
- •Электронная структура атомов и периодическая система элементов
- •Периодичность изменения свойств элементов
- •2.2 Химическая связь
- •Ковалентная химическая связь. Метод вс
- •Основные положения метода вс
- •Механизм образования ковалентной связи
- •Свойства ковалентной связи
- •Ионная связь
- •2.3 Заключение. Свойства соединений в зависимости от типа химичесой связи
2.2 Химическая связь
Учение о химической связи объясняет закономерности, в соответствии с которыми атомы объединяются в молекулы, а также вследствие которых образуется конденсированное состояние вещества ─ твёрдые и жидкие тела.

Химическая связь объясняется с позиций квантовой механики, т.е. поведение электронов в молекулах и конденсированных телах описывается теми же закономерностями, что и поведение электронов в атомах.
Ковалентная химическая связь. Метод вс
В 1927 году В. Гейтлер и Ф. Лондон провели приближённое квантово-механическое описание образования молекулы водорода из двух атомов водорода. На рис. 2.4 показана зависимость потенциальной энергии системы, состоящей из двух атомов водорода, от расстояния между ядрами этих атомов. Известно, что при образовании химической связи происходит снижение энергии системы.
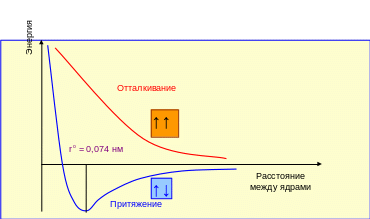
Рис. 2.4 ─ Энергия системы из двух сближающихся атомов водорода
Результат расчёта показал, что одинаковый знак спина взаимодействующих электронов соответствует отталкиванию атомов, т.к. энергия системы непрерывно возрастает при сближении атомов. Если спины электронов имеют противоположное направление, то сближение атомов до некоторого расстояния ─ ro сопровождается уменьшением энергии системы. При межъядерном расстоянии 0,074 нм система из двух атомов водорода обладает наименьшей потенциальной энергией, т.е. находится в наиболее устойчивом состоянии, дальнейшее сближение атомов вновь приводит к увеличению энергии. Таким образом, в случае противоположно направленных спинов образуется молекула Н2 ─ устойчивая система из двух атомов водорода, находящихся на определённом расстоянии друг от друга.
Образование химической связи между атомами водорода является результатом «перекрывания» электронных облаков при сближении атомов (рис. 2.5).

Рис. 2.5 ─ Схема перекрывания электронных облаков
при образовании молекулы водорода

На основе работ Гейтлера и Лондона был разработан метод описания химической связи, названный методом валентных связей (метод ВС).
Основные положения метода вс
1. Ковалентная связь образуется двумя электронами с антипараллельными спинами.
2. При образовании химической связи происходит уменьшение полной энергии системы, электронные облака перекрываются, что приводит к увеличению электронной плотности в межъядерном пространстве.
3. Химическая связь направлена в сторону максимального перекрывания электронных облаков.
Механизм образования ковалентной связи
Общая электронная пара может образоваться в результате взаимодействия двух атомов, имеющих непарные электроны с антипараллельными спинами (обменный механизм) или одного атома, имеющего неподелённую электронную пару и другого атома, имеющего свободную атомную орбиталь (донорно-акцепторный механизм). Обменный механизм иллюстрируется рис. 2.6, где показано образование молекулы азота.

Рис. 2.6 ─ Обменный механизм образования химической связи
в молекуле азота
Атом азота на внешнем электронном уровне имеет три непарных электрона, а поэтому при образовании молекулы азота возникают три ковалентные связи. Количественной мерой валентности в обменном механизме метода ВС считают число непарных электронов у атома в основном или возбуждённом состоянии атома. В данном случае азот трёхвалентен.
При образовании химической связи атом может переходить в возбуждённое состояние (состояние активированного комплекса в химической кинетике), что сопровождается распариванием электронных пар, если есть свободные АО в пределах данного или более низкого электронного уровня. Валентность атомов элементов второго периода в основном и возбуждённом состоянии представлена в табл. 2.7.
Как следует из таблицы, валентность, обусловленная непарными электронами, у элементов второго периода не может превышать значения «четыре».
Таблица 2.7
Валентность элементов в основном (В) и в возбуждённом состоянии (В٭)
-
Элемент
Основное
состояние
В
Возбуждённое
состояние
В٭
2s
2p
2s
2p
Li
↑
1
↑
1
Be
↑↓
0
↑
↑
2
B
↑↓
↑
1
↑
↑
↑
3
C
↑↓
↑
↑
2
↑
↑
↑
↑
4
N
↑↓
↑
↑
↑
3
↑↓
↑
↑
↑
3
O
↑↓
↑↓
↑
↑
2
↑↓
↑↓
↑
↑
2
F
↑↓
↑↓
↑↓
↑
1
↑↓
↑↓
↑↓
↑
1
Ne
↑↓
↑↓
↑↓
↑↓
0
↑↓
↑↓
↑↓
↑↓
0
Неон, как и все инертные газы имеет полностью заполненную внешнюю электронную оболочку, а поэтому устойчивой молекулы Ne2 не может образоваться, такая молекула может существовать очень короткое время в возбуждённом состоянии за счёт дисперсионного взаимодействия.
На рис. 2.7 показан обменный механизм образования ковалентной связи в молекуле SO2.

Рис. 2.7 ─ Обменный механизм образования химической связи в молекуле SO2
В основном состоянии атом серы имеет два непарных электрона на орбитали 3р, при переходе в возбуждённое состояние происходит распаривание электронов на свободную АО 3d. В возбуждённом состоянии атом серы имеет четыре непарных электрона и образует с двумя атомами кислорода четыре ковалентные связи, т.о. сера четырёхвалентна, а кислород ─ двухвалентен.
Для атома серы возможно распаривание ещё одной пары электронов, что увеличивает её валентные возможности до шести. В то же время, несмотря на то, что кислород также находится в шестой группе, он не может быть шестивалентным, т.к. во втором энергетическом уровне разрешены только s и р-орбитали, и свободных орбиталей для распаривания электронов нет.

Донорно-акцепторный механизм образования ковалентной связи иллюстрируется на примере образования иона [NH4]+ .
Cложный ион [NH4]+ образуется из молекулы аммиака и иона водорода:
NH3 + H+ → [NH4]+.
Каждый атом водорода имеет один непарный электрон, азот ─ три, поэтому в молекуле аммиака NH3 возникают три ковалентные связи, образованные по обменному механизму (рис. 2.8). Помимо того, азот имеет также неподелённую пару электронов, которая со свободной АО иона водорода H+ образует ковалентную связь, причём, азот является донором электронной пары, а ион водорода ─ акцептором. Следовательно, в ионе [NH4]+ имеется четыре равноценные ковалентные связи, различающиеся только механизмом образования (рис. 2.9).

Рис. 2.8 – Описание образования химической связи в молекуле аммиака
по обменному механизму

Рис. 2.9 ─ Донорно-акцепторный механизм образования ковалентной связи
в ионе [NH4]+
