
- •Раздел 2. Строение вещества
- •2.1 Строение атома и периодическая система элементов
- •Квантовые числа
- •Принципы распределения электронов в атоме
- •Электронные формулы и энергетические ячейки
- •Электронная структура атомов и периодическая система элементов
- •Периодичность изменения свойств элементов
- •2.2 Химическая связь
- •Ковалентная химическая связь. Метод вс
- •Основные положения метода вс
- •Механизм образования ковалентной связи
- •Свойства ковалентной связи
- •Ионная связь
- •2.3 Заключение. Свойства соединений в зависимости от типа химичесой связи
Электронные формулы и энергетические ячейки
Электронное строение атома может быть представлено в виде электронных формул или энергетических (квантовых) ячеек.
Порядок написания электронных формул следующий:
1) по таблице Д.И. Менделеева находят символ элемента и записывают его;
2) слева внизу от символа ставят порядковый номер элемента, который указывает общее количество электронов в атоме;
3) после символа – последовательно номер энергетического уровня: 1, 2, 3, 4, …, значение которого численно совпадает с главным квантовым числом;
4) затем - тип орбитали (s, p, d, f). Сверху справа над типом орбитали записывают количество электронов.
Ниже представлены электронные формулы и распределение в энергетических ячейках электронов внешних оболочек, которые могут участвовать в образовании химической связи.
Водород, гелий и литий относятся к s-элементам, углерод и неон к р-элементам, а скандий к d-элементам.

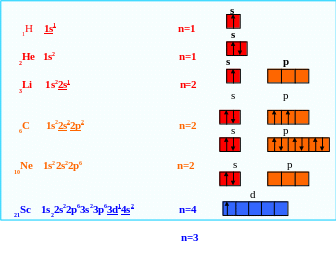

Электронная структура атомов и периодическая система элементов
Периодический закон Д.И. Менделеева, открытый в 1869 году, в настоящее время формулируется так: свойства элементов, а также формы и свойства их соединений находятся в периодической зависимости от заряда ядра их атомов.
Периодическая система элементов является графическим выражением периодического закона. Последовательность расположения элементов в периодической системе согласуется с последовательностью заполнения электронами энергетических уровней и подуровней.
Заполнение каждого последующего уровня K (n=1), L (n=2), M (n=3), N (n=4), Q (n=5) означает новый период, где максимальное значение главного квантового числа соответствует номеру периода, в котором находится химический элемент. Следовательно, к одному периоду относятся элементы, в электронной структуре атомов которых заполняется одно и то же число квантовых уровней. Последовательность энергетических уровней и подуровней элементов первых пяти периодов периодической системы элементов представлена в табл. 2.2 .
Таблица 2.2
Электронная структура атомов и периодическая система элементов
-
Период
Квантовые энергетические уровни и подуровни
Число элементов
в периоде
I
1s2
2
II
1s2 2s2 2p6
8
III
1s2 2s2 2p6 3s2 3p6
8
IV
1s2 2s2 2p6 3s2 3p6 4s23d10 4p6
18
V
1s2 2s2 2p6 3s2 3p6 4s23d10 4p6 5s2 4d10 5p6
18
Периодом называется последовательный ряд элементов, размещённых в порядке возрастания заряда ядра атомов, электронная конфигурация которых изменяется от ns1 до ns2p6 (или до ns2 в первом периоде). Каждый период (кроме первого) начинается со щелочного металла, у которого заполняется одним электроном s-орбиталь внешнего уровня и заканчивается инертным газом, у которого внешняя орбиталь заполняется 8-ю электронами.

Второй и третий (малые) периоды содержат по 8 элементов, Большие периоды помимо s- и р-элементов имеют в своём составе по 10 d-элементов (четвёртый и пятый периоды), а также по 14 f-элементов (шестой и седьмой периоды) (табл. 2.3).
Таблица 2.3
Структура периодической системы элементов
|
Группы и подгруппы элементов |
|||||||||||||||||
IA |
IIA |
IIIB…VIIIB, IB, IIB |
IIIA |
IVA |
VA |
VIA |
VIIA |
VIIIA |
||||||||||
I |
H |
|
|
He |
||||||||||||||
II |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
||||||||||
III |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
Ar |
||||||||||
IV |
K |
Ca |
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
V |
Rb |
Sr |
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
VI |
Cs |
Ba |
La Lu |
Hf |
Ta |
W |
Re |
Os |
Ir |
Pt |
Au |
Hg |
Tl |
Pb |
Bi |
Po |
At |
Rn |
VII |
Fr |
Ra |
Ac Lr |
Ku |
Ns |
|
|
|
|
|
|
|
|
|
|
|
|
|
лантаноиды |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
Dy |
Ho |
Er |
Tm |
Yb |
Lu |
||||
актиноиды |
Th |
Pa |
U |
Np |
Pu |
Am |
Cm |
Bk |
Cf |
Es |
Fm |
Md |
No |
Lr |
||||
Периодическая система содержит восемь групп (по числу электронов на внешнем электронном уровне). Группы элементов делятся на главные и побочные.

Пример. Электронные формулы элементов с порядковыми номерами 22 и 32 имеют следующий вид:
22 Ti 1s22s22p63s23p63d24s2 ─ титан расположен в четвёртом периоде, т.к. заполняется четыре энергетических уровня, в побочной подгруппе (валентные электроны расположены на s- и d-орбиталях). Группа четвёртая (по числу валентных электронов).
32 Ge 1s22s22p63s23p63d104s24р2 ─ германий находится в четвёртом периоде, в главной подгруппе (s- и р-орбиталь) четвёртой группы.

В одних и тех же группах и в одних и тех же подгруппах расположены элементы с одинаковым строением внешних электронных оболочек (электронные аналоги), которые оказывают наибольшее влияние на химические свойства элементов. Поэтому можно сказать, что в одних и тех же группах и подгруппах находятся элементы со сходными свойствами, что находит своё выражение в составе высших оксидов, гидроксидов и летучих водородных соединений (табл. 2.4)
Таблица 2.4
Формулы некоторых соединений в зависимости от положения
элементов в периодической системе
Главные подгруппы периодической системы |
||||||
I |
II |
III |
IV |
V |
VI |
VII |
Число электронов на внешнем электронном уровне |
||||||
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Формулы высших оксидов |
||||||
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7
|
Формулы газообразных водородных соединений |
||||||
|
|
|
ЭН4 |
ЭН3 |
Н2Э |
НЭ
|
Формулы высших гидроксидов |
||||||
ЭОН |
Э(ОН)2 |
Э(ОН)3 |
Н2ЭО3 |
НЭО3 |
Н2ЭО4 |
НЭО4
|

