
- •Раздел 2. Строение вещества
- •2.1 Строение атома и периодическая система элементов
- •Квантовые числа
- •Принципы распределения электронов в атоме
- •Электронные формулы и энергетические ячейки
- •Электронная структура атомов и периодическая система элементов
- •Периодичность изменения свойств элементов
- •2.2 Химическая связь
- •Ковалентная химическая связь. Метод вс
- •Основные положения метода вс
- •Механизм образования ковалентной связи
- •Свойства ковалентной связи
- •Ионная связь
- •2.3 Заключение. Свойства соединений в зависимости от типа химичесой связи
Раздел 2. Строение вещества
Основным законом химии является периодический закон Д.И. Менделеева, теоретическое объяснение которого даётся на основе моделей строения атома.
2.1 Строение атома и периодическая система элементов
Атом представляет собой сложную систему, состоящую из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Сложная структура атома была доказана в конце ХIХ века экспериментально (катодные лучи, радиоактивность). Появились первые модели строения атома, среди которых наибольшую известность приобрела планетарная модель строения атома водорода Н. Бора, основанная на постулатах. Однако теория Бора не объясняла строения многоэлектронных атомов. Итогом дальнейших исследований стало создание квантовой механики, которая изучает движение и взаимодействие микрочастиц, в том числе и электронов в атоме.

В квантово-механической модели строения атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения электрона в определённой области пространства описывается волновой функцией ψ, которая характеризует амплитуду волны, как функцию координат электрона. Орбиталью называется область пространства, в которой наиболее вероятно нахождение электрона.

Орбиталь электрона представляет собой распределение отрицательного заряда и называется электронным облаком. Если ограничить область пространства, где (ψ → 0), то получим графическое изображение атомной орбитали (АО).
Квантовые числа
Для характеристики поведения электронов в атоме введены квантовые числа, которые дают картину распределения электронной плотности (вероятности нахождения электрона) и энергию электрона.


Электронная оболочка любого атома представляет собой сложную систему. Она делится на энергетические уровни, которые пронумерованы, начиная от ядра:
K (n=1), L (n=2), M (n=3), N (n=4), Q (n=5) …, и орбитали: s, p, d, f.
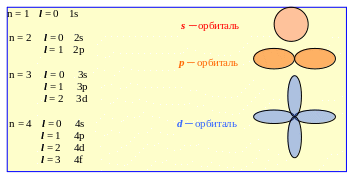

l = 0 ml =0
l = 1 ml = –1, 0, +1
l = 2 ml = –2, –1, 0, +1, +2
l = 3 ml = –3, –2, –1, 0, +1, +2, +3
Таким образом, атомная орбиталь характеризуется определенными значениями квантовых чисел n, l, ml, т.е. определенными размерами, формой и ориентацией в пространстве электронного облака.
Число атомных орбиталей определённого типа рассчитывается по формуле
NAO = ( 2 l + 1)
и фактически равно числу значений магнитного квантового числа для данного типа атомной орбитали. Состоянию s соответствует одна орбиталь (l=0), р–состоянию – три (l=1), d-состоянию – пять (l=2), f –состоянию – семь (l=3) орбиталей.
Атомные орбитали условно изображаются в виде квадратиков.
s-орбиталь р-орбитали d-орбитали f-орбитали


Если на орбитали находится один электрон, то он называется неспаренным (непарным), если два – то это спаренные (парные) электроны, они должны иметь противоположные спины.
Таким образом, состояние электрона в атоме полностью характеризуется набором четырех квантовых чисел: n, l, ml, ms.

