
- •1.) Основные физические величины и соотношения кинематики. Нормальное и тангенциальное ускорения при вращательном движении.
- •Основные кинематические понятия
- •Основные кинематические величины
- •2.) Динамика материальной точки. Законы Ньютона. Силы в механике. Момент силы.
- •Момент силы
- •3.) Импульс. Момент импульса. Их основные свойства и характеристики.
- •4.) Энергия и работа. Консервативные силы. Работа в потенциальном поле. Законы сохранения.
- •Работа, мощность, энергия
- •Потенциальное поле сил
- •5.)Динамика вращательного движения твердого тела. Момент инерции. Теорема Штейнера.
- •Момент инерции
- •6.) Кинетическая энергия вращения. Закон сохранения момент импульса.
- •7.) Законы сохранения и их обусловленность симметрией пространства и времени.
- •Законы Кеплера. Закон всемирного тяготения
- •9.) Специальная теория относительности. Постулаты Эйнштейна. Преобразования Лоренца.. Следствия из преобразований Лоренца.
- •10.) Основные положения общей теории относительности а. Эйнштейна.. Альтернативные теории гравитации.
- •11.) Идеальный газ. Давление и температура. Основное уравнение молекулярно-кинетической теории.
- •13.) Распределение газовых молекул по скоростям (распределение Максвелла). Барометрическая формула. (распределение Больцмана). Изменение распределений при изменениях температуры.
- •14.) Теплота и работа. Теплоемкость. Первое начало термодинамики.
- •15.) Теплоемкость идеального газа. Уравнение Майера.
- •16.) Изопроцессы. Политропический процесс. Газ Ван-дер-Ваальса.
- •17.) Теплоемкость газов. Равномерное распределение энергии по степеням свободы молекул. Массовая, объёмная и мольная удельные теплоёмкости
- •2.2.Средняя и истинная теплоёмкости
- •2.3.Теплоёмкости при постоянном объёме и давлении
- •2.5.Теплоёмкость смеси рабочих тел (газовой смеси)
- •18.) Тепловые и холодильные машины, их к.П.Д. Цикл Карно.
- •19.) Энтропия. Второе и третье начала термодинамики. Статистический смысл энтропии.
- •20.) Явления на границе раздела газа, жидкости и твердого тела. Фазовые переходы первого и второго рода. Капиллярные явления.
- •21)Электрический заряд. Закон Кулона. Напряженность электростатического поля. Принцип суперпозиции.
- •22)Потенциал и работа электростатического поля. Циркуляция вектора напряженности. Связь напряженности с потенциалом.
- •23)Диэлектрики в электростатическом поле. Поляризованность. Свободные и связанные заряды. Вектор d и его связь с векторами е и р.
- •24)Проводники в электростатическом поле. Энергия заряженного проводника и конденсатора. Плотность энергии электростатического поля.
- •25)Носители электрического тока в средах. Сила и плотность тока. Уравнение непрерывности.
- •26)Магнитное поле. Закон Био-Савара-Лапласа. Энергия магнитного поля. Плотность энергии магнитного поля.
- •27)Намагниченность вещества. Вектор напряженности магнитного поля и его связь с векторами индукции и намагниченности. Магнитные свойства веществ.
- •28)Закон Ампера. Магнитный момент контура с током. Контур с током в магнитном поле. Поток вектора магнитной индукции.
- •29)Сила Лоренца. Движение заряженной частицы в электрических и магнитных полях. Ускорение заряженных частиц. Эффект Холла.
- •30)Явление электромагнитной индукции. Правило Ленца. Циркуляция вектора напряженности вихревого электрического поля. Токи Фуко.
- •41.Тепловое излучение. Закон Кирхгофа. Закон Стефана-Больцмана. Закон смещения Вина. Формула Планка.
- •42. Фотоэффект и его виды. Уравнение Эйнштейна для внешнего фотоэффекта.
- •43.Волновые свойства микрочастиц. Гипотеза де Бройля и ее подтверждения. Соотношение неопределенностей Гейзенберга.
- •44.Физический смысл волн де Бройля. Понятие о волновой функции. Уравнение Шредингера.
- •45.Прохождение микрочастиц через потенциальный барьер. Туннельный эффект.
- •46.Ядерная модель атома. Оптические спектры атомов, их закономерности. Теория Бора.
- •47.Квантово-механичекая модель строения атома. Квантовые числа и их смысл. Принцип Паули.
- •48.Строение атомного ядра. Ядерные силы. Энергия связи нуклонов в ядре. Ядерная и термоядерная энергетика.
- •49.Радиоактивность. Закон радиоактивного распада. Виды радиоактивных излучений.
- •50.Элементарные частицы. Их основные характеристики. Виды взаимодействий. Классификация и свойства частиц. Теория кварков и идеи объединения фундаментальных взаимодействий.
44.Физический смысл волн де Бройля. Понятие о волновой функции. Уравнение Шредингера.
Во́лны де Бро́йля — волны, связанные с любыми микрочастицами и отражающие их волновую природу.
Физический смысл
Для частиц не очень высокой энергии, движущихся со скоростью
![]()
(скорости света), импульс равен
![]()
(где
![]()
— масса частицы), и
![]()
. Следовательно, длина волны де Бройля тем меньше, чем больше масса частицы и её скорость.
Волнова́я фу́нкция, или пси-функция
![]()
— комплекснозначная функция, используемая в квантовой механике для описания чистого состояния системы.
Физический смысл волновой функции заключается в том, что согласно копенгагенской интерпретации квантовой механики плотность вероятности нахождения частицы в данной точке пространства в данный момент времени считается равной квадрату абсолютного значения волновой функции этого состояния в координатном представлении.
Пусть волновая функция задана в N-мерном пространстве, тогда в каждой точке с координатами
![]()
, в определенный момент времени t она будет иметь вид
![]()
. В таком случае уравнение Шрёдингера запишется в виде:
![]()
Где
![]()
,
![]()
— постоянная Планка;
— масса частицы,
![]() —
—
внешняя по отношению к частице потенциальная энергия в точке
,
— оператор Лапласа (или лапласиан), эквивалентен квадрату оператора набла и в n-мерной системе координат имеет вид:
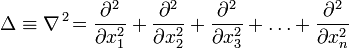
45.Прохождение микрочастиц через потенциальный барьер. Туннельный эффект.
Туннельный эффект (tunnelling) (физ.), прохождение микрочастиц через потенциальные барьеры, для преодоления к-рых им не хватает энергии. Т.э. часто возникает на субатомном уровне. Его природу объясняет квантовая механика. Рассмотрим, напр., электрон, к-рый встречает потенциальный барьер, скажем, электрон, удерживаемый электрич. полем. Электрон обладает волновыми св-вами, а волна характеризуется "размытостью" в пространстве. В точке, где электрон - как частица - встречает потенциальный барьер, он - как протяженная волна - может проникнуть в этот барьер, а если последний достаточно тонок, то и за него. Поскольку электронная волна является мерой вероятности нахождения электрона в нек-ром месте (волновая функция), выход волны за барьер означа-ет, что вероятность нахождения электрона за барьером отлична от нуля, т.е. что электрон может проникнуть сквозь него. Т.э. объясняет мн. явления, включая нек-рые св-ва полупроводников и вылет альфа-частиц из нестабильных ядер.
Про первое посмотрите сами и выберите для себя.. потому что там пиздец..
46.Ядерная модель атома. Оптические спектры атомов, их закономерности. Теория Бора.
Опыт Резерфорда. Ядерная модель атома
Первая
попытка создания модели атома на основе
накопленных экспериментальных данных
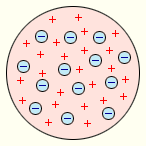
(1903 г.) принадлежит Дж. Томсону. Он считал,
что атом представляет собой
электронейтральную систему шарообразной
формы радиусом, примерно равным 10–10 м.
Положительный заряд атома равномерно
распределен по всему объему шара, а
отрицательно заряженные электроны
находятся внутри него (рис. 6.1.1). Для
объяснения линейчатых спектров испускания
атомов Томсон пытался определить
расположение электронов в атоме и
рассчитать частоты их колебаний около
положений равновесия. Однако эти попытки
не увенчались успехом. Через несколько
лет в опытах великого английского физика
Э. Резерфорда было доказано, что модель
Томсона неверна.
 Рисунок
6.1.1.
Рисунок
6.1.1.
Модель атома Дж. Томсона
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом и его сотрудниками Э. Марсденом и Х. Гейгером в 1909–1911 годах. Резерфорд предложил применить зондирование атома с помощью α-частиц, которые возникают при радиоактивном распаде радия и некоторых других элементов. Масса α-частиц приблизительно в 7300 раз больше массы электрона, а положительный заряд равен удвоенному элементарному заряду. В своих опытах Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц очень велика – порядка 107 м/с, но все же значительно меньше скорости света). α-частицы – это полностью ионизированные атомы гелия. Они были открыты Резерфордом в 1899 году при изучении явления радиоактивности. Этими частицами Резерфорд бомбардировал атомы тяжелых элементов (золото, серебро, медь и др.). Электроны, входящие в состав атомов, вследствие малой массы не могут заметно изменить траекторию α-частицы. Рассеяние, то есть изменение направления движения α-частиц, может вызвать только тяжелая положительно заряженная часть атома. Схема опыта Резерфорда представлена на рис. 6.1.2.
 Рисунок
6.1.2.
Рисунок
6.1.2.
Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп
От радиоактивного источника, заключенного в свинцовый контейнер, α-частицы направлялись на тонкую металлическую фольгу. Рассеянные частицы попадали на экран, покрытый слоем кристаллов сульфида цинка, способных светиться под ударами быстрых заряженных частиц. Сцинтилляции (вспышки) на экране наблюдались глазом с помощью микроскопа. Наблюдения рассеянных α-частиц в опыте Резерфорда можно было проводить под различными углами φ к первоначальному направлению пучка. Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Этот результат был совершенно неожиданным даже для Резерфорда. Его представления находилbcm в резком противоречии с моделью атома Томсона, согласно которой положительный заряд распределен по всему объему атома. При таком распределении положительный заряд не может создать сильное электрическое поле, способное отбросить α-частицы назад. Электрическое поле однородного заряженного шара максимально на его поверхности и убывает до нуля по мере приближения к центру шара. Если бы радиус шара, в котором сосредоточен весь положительный заряд атома, уменьшился в n раз, то максимальная сила отталкивания, действующая на α-частицу, по закону Кулона возросла бы в n2 раз. Следовательно, при достаточно большом значении n α-частицы могли бы испытать рассеяние на большие углы вплоть до 180°. Эти соображения привели Резерфорда к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.
Бора.
Итак, только переход атома из одного стационарного состояния в другое с изменением энергии сопровождается излучением. Бор предположил, что каждая спектральная линия соответствует мгновенному переходу атома из одного квантового состояния в другое, характеризуемое меньшим значением энергии. Избыток энергии уносится излучением. При этом в квантовой теории вполне естественно считать, что энергия излучается в виде отдельных квантов, или фотонов.
Таким образом, при переходе атома из одного стационарного состояния в другое он испускает фотон, энергия которого равна разности энергий начального и конечного состояний атома. Отсюда непосредственно следует так называемое правило частот Бора: частота спектральной линии, соответствующей переходу атома из некоторого состояния A в состояние B, равна разности энергии атома в состояниях A и B, деленной на постоянную Планка h.
Модель атома Н. Бора, разрешавшая эти противоречия, базировалась на планетарной модели Э. Резерфорда и на разработанной им самим квантовой теории строения атома. Н. Бор выдвинул гипотезу строения атома, основанную на двух постулатах, совершенно несовместимых с классической физикой:
1) в каждом атоме существует несколько стационарных состояний (говоря языком планетарной модели, несколько стационарных орбит) электронов, двигаясь по которым электрон может существовать, не излучая;
2) при переходе электрона из одного стационарного состояния в другое атом излучает или поглощает порцию энергии.
Постулаты Бора объясняют устойчивость атомов: находящиеся в стационарных состояниях электроны без внешней на то причины не излучают электромагнитной энергии.
ОПТИЧЕСКИЕ СПЕКТРЫ НЕ НАШЛА НОРМАЛЬНОГО НИЧЕГО.
