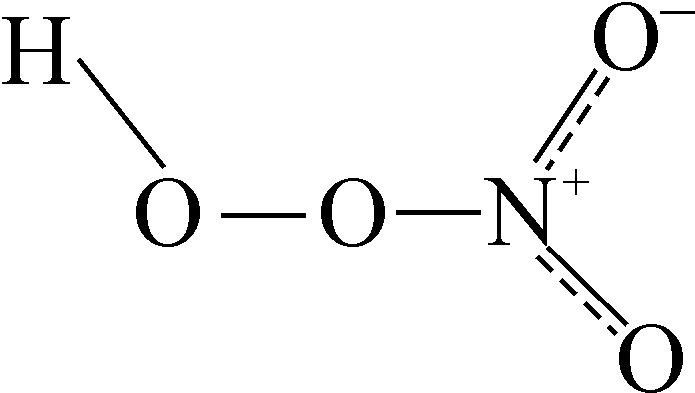- •Змістовий модуль 6. Хімія р-та s-елементів
- •Тема 1. S-біометали і та іі груп (Na, k, Mg, Ca)
- •Загальна характеристика елементів головної підгрупи і та іі груп
- •Лужні метали: поширення в природі, добування
- •Хімічні властивості лужних металів
- •Застосування лужних металів та їх сполук
- •Берилій та лужноземельні метали: поширення у природі, добування. Фізичні властивості
- •Хімічні властивості металів головної підгрупи іі групи
- •Застосування металів головної підгрупи іі групи та їх сполук
- •Твердість води та способи її усунення
- •Тема 2. Розповсюдження біоелементів в природі. Сполуки Гідрогену та Оксисену, властивості, їх біологічна роль. Хімія води. Природні води та способи очистки води.
- •Тема 3. Сполуки Карбону та Сульфуру. Положення в періодичній системі, властивості, добування, фізіологічна дія на організм.
- •Поширеність у природі, способи одержання сірки
- •Властивості Сульфуру
- •Тема 4. Сполуки Нітрогену та Фосфору. Положення в періодичній системі, властивості, поняття про мінеральні добрива. Біологічна роль сполук Нітрогену та Фосфору.
- •Поширеність у природі, способи одержання азоту
- •Фізичні та хімічні властивості азоту. Нітриди
- •Гідрогеновмісні сполуки Нітрогену
- •Оксигеновмісні сполуки Нітрогену
- •Кругообіг Нітрогену в природі
- •Тема 5. Сполуки Хлору та Йоду. Положення в періодичній системі, поширення в природі, властивості, біологічна роль сполук Хлору та Йоду.
- •Особливості електронної будови та загальний огляд властивостей галогенів
- •Поширеність галогенів у природі, способи отримання у чистому вигляді.
- •Загальний огляд хімічних властивостей галогенів
- •Особливості хімії фтору
- •Галогеноводні, особливості зміни властивостей та сили кислот
- •Оксигенвмісні сполуки хлору
- •Основні галузі застосування галогенів та їх сполук
Тема 2. Розповсюдження біоелементів в природі. Сполуки Гідрогену та Оксисену, властивості, їх біологічна роль. Хімія води. Природні води та способи очистки води.
Поширеність у природі, способи одержання кисню.
Властивості кисню та сполук Оксигену. Пероксиди.
Озон, його властивості. Озоніди.
Кругообіг кисню у природі.
Поширеність у природі, способи одержання кисню
Оксиген – найпоширеніший елемент у природі. У земній корі його вміст становить 47 мас. % або 55 ат. %. У вигляді кисню (О2) він міститься у атмосферному повітрі (20,9 об. % або ~23 мас.%). У зв’язаному стані Оксиген входить до складу води, кварцу (SiO2), силікатів, алюмосилікатів, карбонатів, сульфатів, органічних сполук тваринного і рослинного походження. Крім кисню у верхніх шарах атмосфери є проста речовина Оксигену озон О3, максимальна концентрація якого зафіксована на висоті близько 25 км від поверхні Землі. Цей озоновий шар утворився з О2 під дією жорсткого УФ-проміння. Він має дуже важливе значення, оскільки затримує жорстке короткохвильове сонячне проміння, тривала дія якого смертельно небезпечна для всіх живих організмів.
Вперше кисень у чистому вигляді добув шведський хімік К.В. Шеєле у 1772 р., а в 1774 р. його отримав англійський хімік Д. Прістлі з оксиду меркурію (ІІ).
Чистий кисень можна добути з повітря або розкладанням сполук Оксигену.
У промисловості кисень добувають багатоступінчатою дистиляцією зрідженого повітря. Оскільки температура зрідження кисню (–183 оС) вища, ніж температура кипіння азоту (–195,8 оС), атмосферний кисень легше зріджується, тому зріджене повітря містить більше кисню, ніж атмосферне. Під час зберігання зріджене повітря внаслідок випаровування азоту ще більше збільшується на кисень. Із зрідженого повітря добувають також азот та інертні гази, що містяться у повітрі. Під час перегонки повітря спочатку відділяється азот, а кисень залишається у рідкому стані.
При отриманні водню високої чистоти використовують електроліз води, при чому попутно утворюється і кисень:
К: 2H2O + 2e → 2OH– + H2;
А: 2H2O → 4H+ + O2 + 4e.
Кисень дуже високого ступеня чистоти добувають таким способом:
2BaO + O2 = 2BaO2 (500 oC);
2BaO2 = 2BaO + O2 (900 oC).
Кисень можна також добути розкладанням білильного вапна у присутності солей Кобальту або Купруму:
2CaOCl2 = 2CaCl2 + O2.
Невеликі кількості кисню можна добувати, розкладаючи пероксид гідрогену Н2О2 в присутності каталізатора – платинової фольги, вкритої платиновою черню:
2Н2О2 = 2Н2О + О2.
У лабораторії кисень добувають розкладанням різних оксигенвмісних спо-лук – оксидів, пероксидів, солей: 1) термічний розклад оксидів:
2HgO = 2Hg + O2;
3MnO2 = Mn3O4 + O2;
2PbO2 = 2PbO + O2;
2) розкладання нітратів лужних і лужноземельних металів при нагріванні:
2KNO3 = 2KNO2 + O2;
3) взаємодія оксиду мангану (IV) з конц. сульфатною кислотою:
2MnO2 + 2H2SO4 = 2MnSO4 + 2H2O+ O2;
4) розклад пероксидів при дії води або окcиду карбону (IV):
4KO2 + 2H2O = 4KOH + 3O2;
2Na2O2 + 2CO2 = 2Na2CO3 + O2;
5) термічний розклад перманганату або хлорату калію:
2KMnO4 = K2MnO4 + MnO2 + O2↑;
2KClO3 = 2KCl + 3O2 (в присутності MnO2);
6) розклад хроматів або дихроматів у присутності сульфатної кислоти:
2K2Cr2O7 +8H2SO4 = 2K2SO4 + 2Cr2(SO4)3 + 3O2 + 8H2O.
Застосування кисню:
для інтенсифікації низки хімічних процесів у металургії та хімічній промисловості (доменного, при виробництві сульфатної та нітратної кислот тощо);
для досягнення високих температур (до 3200 оС) спалюванням сумішей горючих газів (водню, ацетилену) з киснем у спец. пальниках;
рідкий кисень – високоефективний окисник ракетного палива;
в медицині – кисневі подушки, палати;
в апаратах для дихання при підземних та підводних роботах, на космічних кораблях.
Властивості кисню та сполук Оксигену
Кисень – безбарвний газ без запаху, трохи важчий за повітря (1 л кисню за н.у. має масу 1,43 г, а 1 л повітря – 1,293 г).
Малорозчинний у воді – у 100 л води при 0 оС розчиняється 5 об’ємів кисню, а при 20 оС – лише 3 об’єми.
Зріджений кисень – це блакитна рідина, що кипить при –183 оС, а затвердіває при –219 оС.
Критична температура кисню (вище якої він не зріджується) становить –118 оС, а критичний тиск кисню дорівнює 5035,85 кПа.
Молекули О2 характеризуються високою міцністю: стандартна ентальпія атомізації кисню рівна 498 кДж/моль, а міжатомна віддаль рівна 0,121 нм (для порівняння, сума радіусів атомів О становить 0,148 нм). Дисоціація молекули О2 на атоми стає помітною за температур 1500–2000 оС. Причина – у молекулі кисню є кратний зв’язок:
![]() .
.
(трьома точками позначено зв’язок, зумовлений двома зв і одним розп –електроном)
З позицій методу МО ЛКАО будова молекули кисню виглядає так:
(sзв)2 (sрозп)2 (xзв)2 (y,zзв)4 (yрозп)1 (zрозп)1
У молекулі О2 зв’язок подвійний, бо надлишок зв’язуючих електронів становить 4.
Наявністю в молекулі кисню двох неспарених електронів пояснюється його парамагнетизм. Так, рідкий і твердий кисень притягується до магніту.
У сполуках атоми Оксигену можуть перебувати у стані sp3-, sp2- та sp-гібридизації, що відповідає тетраедричному, трикутному або лінійному розміщенню -зв’язків. Два останніх гібридизованих стани атома Оксигену стабілізуються за рахунок утворення відповідно одного і двох -зв’язків. Прикладами сполук, де виявляються sp3-, sp2- та sp-гібридизовані стани атома О відповідно можуть бути кристалічні ВеО, TiO2 i SiO2. Кратність зв’язку Si–O–Si та Ti–O–Ti перевищує одиницю за рахунок -зв’язування.
Наявністю в атома Оксигену двох неподілених пар електронів зумовлена можливість донорно-акцепторної взаємодії й утворення оксонієвих сполук, в яких атоми Оксигену сполучені трьома ковалентними зв’язками, наприклад іони гідроксонію в кислих розчинах Н3О+ (або навіть Н9О4+).
Кисень розчиняється у деяких розплавлених металах (срібло, платина, золото, паладій). Наприклад, в 1 об’ємі срібла розчиняється близько 10 об’ємів О2.
Кисень має високу хімічну активність. За реакційною здатністю поступається лише галогенам. Взаємодія багатьох речовин з киснем часто має характер горіння.
Кисень потрібен для життєдіяльності більшості живих організмів (винятком є анаеробні бактерії, які розвиваються у безкисневому середовищі). При недостачі кисню знижується життєдіяльність організму і може настати його загибель. З другого боку, надлишок кисню інтенсифікує процеси обміну в організмі, внаслідок чого організм швидко зношується.
З більшістю простих речовин кисень утворює оксиди в результаті безпосередньої взаємодії. За електронегативністю (3,5) кисень поступається лише фтору, тому в усіх сполуках проявляє негативні СО (–2, –1). Винятком є фторид оксигену OF2, де СО Оксигену дорівнює +2, і кисень виявляє відновні властивості. Крім того, з киснем безпосередньо не взаємодіють інертні гази, деякі шляхетні метали (Au, Ir), галогени, азот.
Більшість металів і неметалів, а також складні речовини (в т.ч. органічні) енергійно реагують з киснем:
2Mg + O2 = 2MgO;
S + O2 = SO2;
4Fe + 3O2 = 2Fe2O3;
4P + 5O2 = 2P2O5;
CH4 + 2O2 = CO2 + 2H2O;
2SO2 + O2 = 2SO3.
Окиснення, що відбувається з інтенсивним виділенням тепла і світла, називається горінням. Повільне окиснення органічних речовин називається гниттям.
Сполуки Оксигену, в яких він проявляє СО –2, – це оксиди. Властивості оксидів в періодах і групах періодичної системи при русі згори униз або зліва направо закономірно змінюються. Так, в групах при збільшенні порядкового номера елемента посилюються основні і послаблюються кислотні властивості оксидів, а у періодах – навпаки. Наприклад, для елементів третього періоду спостерігається така зміна властивостей їх оксидів:
N |
MgO
|
A |
S |
P2O5 |
SO3 |
Cl2O7 |
основні оксиди |
амфотерний оксид |
кислотні оксиди |
||||
Відмінність властивостей різних оксидів виявляється при їх взаємодії з водою, а також під час взаємодії оксидів різного типу між собою.
Внаслідок
приєднання до молекули кисню одного
електрона утворюється супероксид-іон
![]() .
Так, під час взаємодії активного лужного
металу, наприклад калію, з киснем
утворюється супероксид (надпероксид
або оксогенід), калію:
.
Так, під час взаємодії активного лужного
металу, наприклад калію, з киснем
утворюється супероксид (надпероксид
або оксогенід), калію:
K+ O2 = KO2.
Супероксиди є парамагнетиками (втягуються у магнітне поле), оскільки в іоні є неспарений електрон.
Якщо ж
до молекули кисню приєднаються два
електрони, то утвориться пероксид-іон
![]() ,
в якому атоми сполучені між собою одним
двохелектронним зв’язком, і тому цей
іон діамагнітний. Пероксиди утворюються
при окисненні багатьох активних металів:
,
в якому атоми сполучені між собою одним
двохелектронним зв’язком, і тому цей
іон діамагнітний. Пероксиди утворюються
при окисненні багатьох активних металів:
Ba + O2 = BaO2.
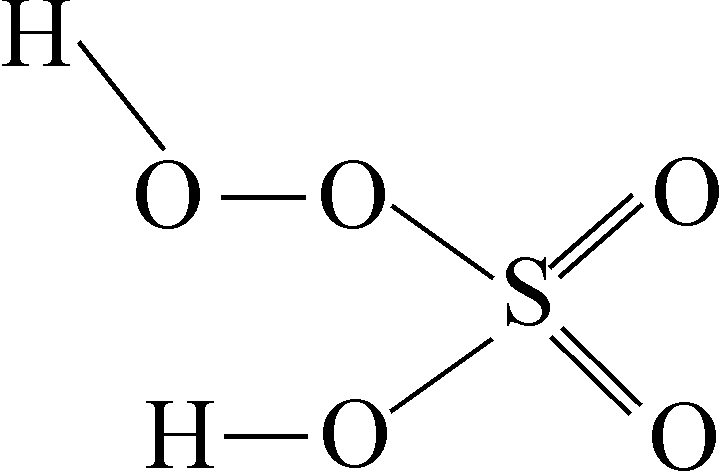
Найбільше практичне значення має пероксид гідрогену.
Кислоти, що містять угруповання , називаються пероксокислотами або надкислотами. Наприклад,
|
|
Пероксонітратна кислота |
Пероксосульфатна кислота |
При гідролізі пероксикислот утворюється пероксид гідрогену, що широко використовується в промисловості. Всі пероксидні сполуки є сильними окисниками (здебільшого сильнішими, ніж Н2О2). При незначному нагріванні вони розкладаються з виділенням кисню.
Атом
Оксигену піддаються позитивній
поляризації в сполуках з Фтором в
похідних
![]() -радикала:
OF2,
O2F2,
ClO4F,
[PtF6],
[SbF6]
тощо.
-радикала:
OF2,
O2F2,
ClO4F,
[PtF6],
[SbF6]
тощо.
Озон, його властивості. Озоніди
При проходженні через кисень тихого електричного розряду утворюється його алотропна видозміна – озон. Молекула озону складається з трьох атомів Оксигену, діамагнітна, має кутову будову (кут ООО дорівнює 116,5о) і довжину зв’язків О–О, що становить 0,128 нм. Шести зв’язуючим електронам відповідає кратність зв’язку 1,5.
Структуру
молекули озону можна подати схемою:
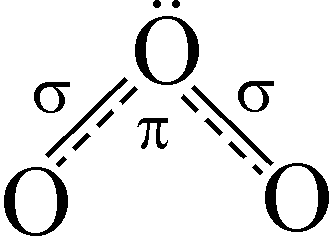 .
.
Пунктирні лінії вказують на делокалізацію -електронної пари, тобто -зв’язок в молекулі озону трицентровий. В молекулі озону атоми Оксигену перебувають у sp2-гібридизованому стані.
Озон отримують при дії тихих електричних розрядів на кисень у спеціальних приладах – озонаторах. Концентрація озону в газі, що виходить з озонатора становить кілька відсотків (до 10%).
Реакція утворення озону перебігає за ланцюговим механізмом:
3О2 = 2О3, H0298= 142,5 кДж/моль, S < 0, G > 0 (163 кДж/моль).
Таким чином, для перебігу цієї реакції потрібно затратити додаткову енергію. Тому молекула О3 нестійка і за великих концентрацій озон розкладається з вибухом.
Озон також отримують при різних електрохімічних процесах. Наприклад, при електролізі концентрованих розчинів перхлоратної кислоти HClO4 на аноді разом із киснем виділяється озон. У техніці рідкий озон добувають опроміненням зрідженого О2 -променями 60Со при наявності каталізатора.
Невеликі кількості озону утворюються внаслідок перебігу деяких хімічних реакцій, наприклад:
3F2 + 3H2O = 6HF + O3.
У природі озон утворюється з кисню повітря при грозових розрядах, а на висоті 10-30 км – під дією УФ-променів Сонця.
Озон – газ, що має синій колір і різкий запах. Рідкий озон має темно-синє, а твердий – чорне забарвлення. Температура кипіння озону –111,9 оС, а температура плавлення –193 оС.
Озон отруйний, у рідкому і твердому станах – вибухонебезпечний. Значно краще розчиняється у воді, ніж кисень: у 100 об’ємах води при температурі 0 оС може розчинитися 49 об’ємів озону.
ГДК озону у повітрі – 10–5%. У навколоземному шарі атмосфери вміст озону дорівнює 10–7– 10–6%.
Озон є значно сильнішим окисником, ніж кисень. За звичайних умов озон окиснює такі малоактивні метали, як срібло, ртуть тощо:
8Ag + 2O3 = 4Ag2O + O2.
Озон окиснює всі метали, крім золота і платиноїдів, та більшість неметалів.
Внаслідок взаємодії озону з лужними металами утворюються озоніди:
K + O3 = KO3.
В
озонідах позитивно заряджені іони
металів з’єднані з негативно зарядженими
іонами
![]() .
Наявність в іоні
неспареного електрона є причиною
парамагнетизму озонідів. Озоніди мають
темно-червоний колір.
.
Наявність в іоні
неспареного електрона є причиною
парамагнетизму озонідів. Озоніди мають
темно-червоний колір.
Якісна реакція на озон – взаємодія його з йодидом калію:
2KJ + O3 + H2O = J2 + 2KOH + O2.
При наявності у повітрі озону йодкрохмальний папірець одразу синіє.
Застосування озону:
для знезараження води і дезінфекції повітря;
в деяких хімічних синтезах (особливо органічних);
у суміші з зрідженим киснем (до 24% О2 і до 60% О3) як окисник ракетного палива.
Кругообіг кисню у природі
Як уже вказувалося, Оксиген є найпоширенішим елементом на Землі. У морській воді міститься 85,82% Оксигену, в атмосферному повітрі 23,15% мас. або 20,93% об., а у земній корі –47,2% мас.
Концентрація вільного кисню в атмосфері підтримується сталою завдяки процесу фотосинтезу, при якому зелені рослини під дією сонячного світла перетворюють оксид карбону (IV) і воду у вуглеводи і кисень. Проте головна маса Оксигену знаходиться у зв’язаному стані, кількість молекулярного кисню в атмосфері оцінюють в 1,51015 т, що складає всього лиш 0,01% від загального вмісту оксигену в земній корі.
В природі кисень виконує надзвичайно важливу роль. Кисень та його сполуки незамінні для підтримання життя. Вони відіграють важливу роль у процесах обміну речовин і дихання. Оксиген входить до складу білків, жирів, вуглеводів, з яких побудовані живі організми. Наприклад, в організмі людини міститься близько 65% Оксигену. Більшість організмів отримують енергію, необхідну для виконання їхніх життєвих функцій, внаслідок окиснення тих чи інших речовин за участю кисню. Зменшення вмісту кисню в атмосфері в результаті процесів дихання, гниття і горіння поповнюється киснем, що виділяється при фотосинтезі. Споживання атмосферного кисню для дихання та його відтворення рослинами в процесі фотосинтезу здійснюється досить швидко. Розрахунки показують, що для повного поновлення всього атмосферного кисню потрібно близько двох тисяч років. З іншого боку, для того, щоб всі молекули води гідросфери були піддані фотолізу і знов синтезовані живими організмами, необхідно два мільйони років.
Крім фотосинтезу, значним джерелом кисню є, як вважають, фотоліз водяної пари у верхніх шарах атмосфери під дією УФ-променів Сонця. Таким чином, в природі неперервно здійснюється кругообіг кисню, що підтримує сталість складу атмосферного повітря. Крім того, зв’язаний Оксиген здійснює кругообіг у складі води: випаровування її з поверхні моря і суші, перенос повітряними масами і вітрами, конденсація парів, випадання опадів у вигляді дощу, снігу, граду, туману.
Отже, геохімічний кругообіг кисню пов’язує газову та водну оболонки з земною корою. Його основні моменти:
виділення вільного кисню при фотосинтезі;
окиснення хімічних елементів;
надходження максимально окиснених сполук у глибокі зони земної кори та їх часткове відновлення (в т.ч. сполуками карбону);
винесення оксиду карбону (IV) і води на поверхню земної кори і включення їх в процес фотосинтезу.
Встановлені в біосфері об’єми потоків кисню і оксигенвмісних сполук в сучасних умовах порушуються техногенним впливом. Вирубування лісів, ерозія ґрунтів, різноманітні гірничо-видобувні роботи на поверхні зменшують загальну масу фотосинтезу і знижують кругообіг кисню на значних територіях. Промислові , побутові та сільськогосподарські відходи, потрапляючи у природні водойми (ріки, озера, моря, океани), зв’язують розчинений у воді кисень, що також зменшує об’єми кисневих потоків у біосфері.
Озоновий шар. У повітрі завжди міститься озон, концентрація якого біля земної поверхні становить 10–6%. Озон утворюється у верхніх шарах атмосфери з молекулярного кисню під дією сонячної радіації.
Озоновий “екран” розміщений у стратосфері, на висотах від 7-8 км на полюсах, 17-18 км на екваторі, і до 50 км над рештою поверхні Землі. Найтовщим цей шар є на висоті 22-24 км над поверхнею.
Шар озону дуже тонкий. Якби весь озон зосередити біля поверхні Землі, то утворилася би плівка товщиною 2-4 мм (мінімум – біля екватора, максимум – біля полюсів). Проте і ця плівка надійно захищає нас від шкідливого впливу жорсткого УФ-випромінювання Сонця та жорстокого космічного проміння. Без озонового екрану життя збереглося б лише у океанічних глибинах (до 10 км) і в тих шарах гранту, куди не потрапляє сонячна радіація.
Озон поглинає деяку частину інфрачервоного (теплового) випромінювання Землі. Завдяки цьому він затримує близько 20% випромінювання Землі, збільшуючи зігріваючу дію атмосфери.
Озон – отруйний газ і при великих вмістах у повітрі шкідливо впливає на здоров’я людини. Звичайна його концентрація в атмосфері є нешкідливою, проте вона зростає у великих містах з інтенсивним рухом автомобілів внаслідок фотохімічних перетворень вихлопних газів машин.
Причини послаблення озонового екрану. В останні десятиріччя виявлено, що озоновий шар роками повільно, але невпинно зменшується над деякими районами земної кулі, в тому числі над густонаселеними районами середніх широт Північної півкулі. Також велика “озонова діра” виявлена над Антарктидою.
Вміст стратосферного озону над Антарктидою у весняні місяці почав помітно знижуватися ще з 1975 р. В середині 1980-х років його концентрація зменшилась вже на 40%. В той час розміри озонової діри досягли приблизно площі США. На початку 80-х років аналогічну діру виявили над Арктикою, але вона мала меншу площу і падіння рівня озону в ній було меншим (до 9%). В середньому по Землі з 1979 во 1990 рр. вміст озону знизився на 5%.
Руйнування озону відбувається під дією УФ-радіації, космічних променів, деяких газів: сполук нітрогену, хлору і брому, фторхлорвуглеводнів (фреонів). Діяльність людини, яка є причиною руйнування озонового екрану, викликає найбільшу тривогу. Тому низка країн підписала міжнародну угоду про скорочення виробництва озоноруйнуючих речовин. Але озоновий шар руйнують також реактивна авіація і деякі запуски космічних ракет.
Серед основних причин руйнування озонового екрану такі:
запуски космічних ракет. Паливо, що згоряє, “випалює” в озоновому шарі великі діри. Колись вважали, що такі діри швидко затягуються. Як виявилось, ні. Вони існують досить довго.
літаки, які літають на висотах 12-15 км. Пара та інші речовини, які вони викидають, руйнують озоновий шар. З другого боку, літаки, що літають на висотах до 12 км, навпаки, збільшують вміст озону (фотохімічний смог у великих містах);
оксиди нітрогену. Їх викидають ті ж літаки, але найбільше їх виділяється з поверхні ґрунту, особливо при розкладанні азотних добрив;
хлор і його оксигенвмісні сполуки. Величезні кількості цих газів надходять в атмосферу внаслідок розкладання фреонів.
Фреони – це фтор- і хлорпохідні вуглеводнів, які є хімічно інертними. Вони киплять за кімнатної температури, тому різко збільшують свій об’єм, завдяки чому використовуються як розпилювачі. Оскільки при їх розширенні знижується температура, то фреони широко використовують у холодильних установках.
Щороку вміст фреонів в атмосфері зростає на 8-9%. Вони поступово піднімаються втору, в стратосферу і під дією сонячних променів стають активними – вступають у фотохімічні реакції, виділяючи атомарний хлор. Кожна частинка хлору може зруйнувати сотні і тисячі молекул озону.
Вивчення проблеми озонового шару. У 1985 р. прийнята Віденська конвенція по захисту озонового шару, згодом вона доповнена Монреальським протоколом (1987 р.) і поправками до нього Лондонської (1990 р.) і Копенгагенської (1992 р.) конференцій. Сьогодні заборонене виробництво агресивних по відношенню до озонового шару фреонів. Проте час перебування уже наявних в атмосфері фреонів оцінюється від 60 до 400 років. За оцінками деяких експертів озону в атмосфері Землі стало менше на 8%, а швидкість зменшення досягла 0,5% у рік. Сучасне послаблення озонового екрану планети виражається в утворенні щонайменше двох гігантських сезонних озонових дір. Вони відкриваються не лише над полюсами і у високих широтах, але й часто досягають середніх широт.
Зниження концентрації озону на 1% призводить в середньому до зростання інтенсивності жорсткого УФ-проміння біля поверхні землі на 2%. За дією на живі організми жорсткі УФ-промені нагадують гама-промені з тією лише відмінністю, що УФ-промені мають більшу довжину хвилі і відповідно меншу проникаючу здатність, тому уражають, як правило, поверхневі органи. Жорсткий ультрафіолет має достатню енергію, щоб руйнувати ДНК та інші органічні молекули, викликаючи такі захворювання як рак шкіри, меланома, катаракта, ослаблення імунітету.
Жорсткі УФ-промені погано поглинаються водою і тому несуть певну небезпеку морським екосистемам. Експерименти показали, що планктон, який живе у приповерхневому шарі води, при зростанні інтенсивності УФ-опромінення може сильно постраждати, навіть загинути цілком. Потрібно зазначити, що планктон є в основі харчової піраміди практично усіх морських екосистем, тому без перебільшення можна сказати, що практично все життя у приповерхневих шарах морів та океанів може зникнути. Так само при зростанні дози УФ-проміння можуть постраждати і наземні рослини, хоча вони менш чутливі до дії ультрафіолету.
Під тиском цих аргументів ряд країн почали вживати заходи, спрямовані на скорочення виробництва і використання хлорфторвуглеводнів (ХФВ). У США їх використання в аерозолях заборонене з 1978 р. У вересні 1987 р. 23 країни світу у Монреалі підписали конвенцію, що зобов’язує їх знизити споживання ХФВ. В якості пропелента в аерозолях пропонується використовувати пропанбутанову суміш, але вона має той недолік, що вогненебезпечна. Тим не менше такі аерозолі зараз виробляють у багатьох країнах. Складнішою є проблема холодильних установок. Найкращим на сьогодні замінником фреонів є аміак, проте він токсичний і поступається фреонам за фізичними параметрами. Непогані результати отримані для повністю фторованих вуглеводнів. Розробки нових замінників провадяться у багатьох країнах, отримані непогані практичні результати, проте повністю ця проблема ще не вирішена.
Використання фреонів продовжується і поки що далеко навіть до стабілізації рівня фреонів в атмосфері. Так, за даними мережі Глобального моніторингу змін клімату, у фонових умовах – на берегах Тихого і Атлантичного океанів і на островах, далеко від промислових і густонаселених районів – концентрація фреонів -11 і -12 на даний час зростає із швидкістю 5-9% в рік. Вміст в стратосфері фотохімічно активних сполук хлору зараз в 2-3 рази вищий порівняно з рівнем 50-х років, до початку інтенсивного виробництва фреонів.
Водень, гідроген
Положення Гідрогену у Періодичній системі.
Одержання водню.
Фізичні властивості. Ізотопи Гідрогену.
Хімічні властивості Гідрогену. Гідриди.
Застосування водню.
1. Положення Гідрогену в Періодичній системі. Водень відкрив у першій половині XVI ст. німецький лікар та природознавець Парацельс. Англійський фізик і хімік Г. Кавендіш у 1776 р. вивчив його властивості і вказав на відмінності від інших газів. У 1783 р. Лавуазьє вперше отримав водень із води і довів, що вода є хімічною сполукою водню з киснем.
Гідроген, H – перший елемент Періодичної системи Д.І. Менделєєва. Його електронна конфігурація 1s1 аналогічна будові зовнішнього електронного рівня лужних металів. Як і лужні метали, у більшості сполук Гідроген проявляє ступінь окиснення +1 (у сполуках з активними неметалами). Проте тут немає повної аналогії, оскільки у лужних металів втрата електрона призводить до утворення стійкої оболонки інертного газу, а втрата електрона Гідрогеном призводить до утворення елементарної частинки – протона, розміри якого значно менші, ніж розміри будь-якого іншого катіона.
За фізичними властивостями проста речовина – водень – нагадує галогени. За звичайних умов це газоподібна речовина, молекули якої складаються з двох атомів, як і молекули галогенів. До завершення електронного шару елемента не вистачає одного електрона. Тому його атом може приєднувати електрон і виявляти негативний ступінь окиснення –1 (у сполуках з активними металами). Така властивість характерна і для галогенів. Таким чином, Гідроген за хімічними властивостями більш нагадує лужні метали, за фізичними – галогени.
Формальне зарахування Гідрогену до однієї з підгруп не дає змоги передбачити всі його властивості за аналогією з властивостями інших елементів цих підгруп. Тому Гідроген можна розглядати як особливий хімічний елемент, який не має повних аналогів.
Гідроген – найлегший елемент. Його вміст у земній корі (кларк) становить близько 1% за масою (або 16% атомних). В атмосфері вміст Гідрогену у вигляді простої речовини (водню) становить близько 10–5%. Близько 30% (об.) вільного водню входить до складу вулканічного газу. Основним джерелом надходження вільного водню в атмосферу є його виділення під час виверження вулканів, з бурових свердловин. На Землі основна кількість Гідрогену перебуває у зв’язаному стані, він входить до складу багатьох мінералів, всіх органічних речовин, нафти, природного газу, а також води (11 %), яка покриває майже ¾ земної кулі.
Значно більше Гідрогену є у космосі. Близько половини маси Сонця та інших зірок припадає на Гідроген. Він входить також до складу міжзоряного газу, міститься в космічних туманностях. Термоядерна реакція перетворення Гідрогену на Гелій є основним джерелом енергії зірок.
2. Одержання водню. В лабораторних умовах водень одержують:
В результаті взаємодії металів із хлоридною або розведеною сульфатною кислотою (в апараті Кіппа):
2HCl + Zn = ZnCl2 + H2.
В результаті взаємодії активних металів з водою:
Ca + 2H2O = Ca(OH)2 + H2.
В результаті взаємодії з лугами металів, сполуки яких виявляють амфотерні властивості:
Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2;
2Al + 6NaOH + 6H2O = 2Na3[Al(OH)6] + 3H2.
В процесі електролізу води, в якій для підвищення електропровідності розчиняють сильний електроліт (луг або сульфат лужного металу):
К: 2H2O + 2e → 2OH– + H2;
А: 2H2O → 4H+ + O2 + 4e.
Цим методом отримують дуже чистий водень. Найчастіше в лабораторних умовах проводять електроліз водних розчинів КОН або NaOH. Електроди виготовляють з листового нікелю, оскільки такі електроди не кородують у розчинах лугів, навіть тоді, коли вони є анодами. Концентрацію розчинів лугів підбирають так, щоб вона була максимальна (25%-ний NaOH і 34%-ний КОН).
В промисловості водень добувають, здебільшого, з природного газу. Під час нагрівання до 1000 оС суміші природного газу з водяною парою і киснем за наявності каталізатора відбуваються реакції:
CH4 + H2O = СO + 3H2;
2CH4 + O2 = 2СO + 4H2.
Ці процеси називають пароводяною та кисневою конверсією метану. Потім СО каталітично окиснюють водяною парою (конверсія оксиду карбону (ІІ)):
CО + H2O = СO2 + H2.
Каталізатором цього процесу є активований Fe2O3 (активатори – Cr2O3, Al2O3 тощо). Для відділення СО2 cуміш газів промивають водою під тиском або пропускають через розчини лугів:
СO2 + H2О H2CO3;
CO2 + 2KOH = K2CO3 + H2O.
Джерелом СО для добування водню конверсією оксиду карбону (ІІ) є також водяний газ, який отримують обробкою розпеченого вугілля водяною парою в спеціальних апаратах – газогенераторах. В результаті отримують суміш водню і оксиду карбону (ІІ), яку й називають водяним газом:
C + H2O = СO + H2.
Промисловим методом добування водню є низькотемпературне охолодження коксового газу або газів переробки нафти (усі гази, крім водню, в цих умовах зріджуються). Таким способом добувають близько 25% водню. Транспортують водень у стальних балонах під підвищеним тиском.
3. Фізичні властивості водню. Водень – безбарвний газ, без запаху і смаку, найлегший з усіх відомих газів (він у 14,4 раза легший за повітря. За н.у. маса 1 л водню становить 0,09 г. Малорозчинний у воді (при температурі 0 оС і тиску 101 кПа у 1 л води розчиняється 18 мл водню), але добре розчиняється у деяких металах – нікелі, паладії, платині.
Температура кипіння зрідженого водню дорівнює –252,8 оС. Під тиском за температури нижчої –240 оС зріджується у безбарвну прозору рідину. Температура плавлення твердого водню становить –259,2 оС.
Маючи невелику молекулярну масу, водень легко проходить (дифундує) через пористі перегородки і навіть через нагріту металеву перегородку. Саме тому гумові кульки, наповнені воднем і дуже щільно зав’язані, за якийсь час “здуваються”.
Природний водень має два ізотопи – протій 1Н і дейтерій 2Н (D), які є стабільними нуклідами. Нормальний ізотопний склад природних сполук Гідрогену відповідає співвідношенню D : H = 1 : 6800 (за числом атомів). Штучно добуто третій ізотоп – тритій 3Н, що є β-радіоактивним елементом з перідом піврозпаду 12,26 року:
![]() .
.
У природі тритій зустрічається надзвичайно рідко.
Оскільки ядро Гідрогену складається тільки з одного протона, то додавання лише одного нейтрона збільшує його масу удвічі, а двох – утричі. Тому, на відміну від ізотопів решти елементів, ізотопи Гідрогену істотно відрізяються за властивостями. Для речовин, утворених дейтерієм і тритієм, спочтерігаються вищі температури кипіння, зміна швидкостей хімічних реакцій тощо, у порівнянні з такими для речовин, утворених протієм.
4. Хімічні властивості. Гідриди. Атом Гідрогену має лише один електрон, тому при утворенні хімічних сполук він може або віддавати його, або утворювати спільну електронну пару, або приєднувати ще один електрон, утворюючи двохелектронну зовнішню оболонку, як у інертного газу Гелію.
Внаслідок малого заряду ядра атом Гідрогену порівняно слабо притягує електрони і може приєднувати їх лише у тому випадку, коли інший елемент їх легко віддає. Такими елементами є лужні та лужноземельні метали, які при нагріванні в атмосфері водню утворюють солеподібні сполуки – гідриди:
2K + H2 = 2KH (гідрид калію);
Ca + H2 = CaH2 (гідрид кальцію).
У гідридах ступінь окиснення атома Гідрогену дорівнює –1. Тому гідриди мають сильні відновні властивості та здатні відновлювати навіть воду:
NaH + H2O = NaOH + H2.
У гідридах водень веде себе як типовий галоген, а гідриди можна розглядати як аналоги галогенідів. Гідриди можуть бути іонними, ковалентними та іонно-ковалентними. Іонними є гідриди лужних і лужноземельних металів (NaH, CaH2 та ін.), які є твердими кристалічними речовинами з високими температурами плавлення. В хімічному відношенні іонні гідриди поводять себе як основні сполуки.
Гідриди менш електронегативних, ніж Гідроген, неметалічних елементів, наприклад SiH4, B2H6, належать до ковалентних. За хімічною природою – це кислотні сполуки. Відмінність у хімічній природі цих сполук легко виявляється при їх гідролізі, який відбувається за окисно-відновним механізмом з виділенням молекулярного водню:
KH–1 + HOH+1 = KOH + H20 (основний гідрид гідролізує з утворенням лугу);
SiH–14 + 4HOH = H4SiO4 + H20 (кислотний гідрид гідролізує з утворенням кислоти).
Основні та кислотні гідриди можуть взаємодіяти між собою:
2LiH + B2H6 = 2Li[BH4] (тетрагідридоборат літію).
Ця реакція може відбуватися лише у неводних розчинах (в ефірі). Гідрид літію є донором пари електронів (передає в комплекс іон Н–), а B2H6 є акцептором (приєднує Н–).
Прикладом амфотерного гідриду може бути AlH3, який залежно від природи другого учасника реакції виявляє або основні або кислотні властивості:
2AlH3 + 3B2H6 = 2Al[BH4]3 (тетрагідридоборат алюмінію);
основний
KH + AlH3 = K[AlH4] (тетрагідридоалюмінат калію).
кислотний
Перехідні метали утворюють гідриди з переважно металічним типом зв’язку. Всі ці сполуки є фазами включення атомів Гідрогену у пустоти щільноупакованих металічних граток. Вони володіють металічним блиском, електропровідністю, але дуже крихкі. Склад більшості металоподібних гідридів не відповідає правилам формальної валентності і описується формулами МеН та МеН2, іноді МеН3. Прикладами є гідриди титану, ванадію, хрому. Дуже велику кількість водню може розчиняти паладій (за звичайних умов у 1 об’ємі Pd розчиняється до 700 об’ємів Н2).
В полімерних гідридах (наприклад, гідридах цинку та алюмінію) атоми металів зв’язані один з одним водневими “містками”.
Проте для Гідрогену є більш характерними сполуки, в яких він проявляє ступінь окиснення +1. При цьому атом Гідрогену віддає електрон і проявляє властивості відновника.
Водень взаємодіє з багатьма неметалами. Залежно від активності неметалів реакція може перебігати з різною швидкістю. Так, з фтором водень завжди реагує з вибухом:
F2 + H2 = 2HF (фтороводень).
Хлор взаємодіє з воднем значно спокійніше: в темряві і без нагрівання реакція перебігає досить повільно, на світлі – значно енергійніше, а за наявності ініціатора (іскра, нагрівання, УФ-світло) – з вибухом (за ланцюговим механізмом). Тому суміш хлору з воднем є гримучою і вимагає надзвичайної обережності в поводженні. У всіх випадках реакція відбувається так:
Cl2 + H2 = 2HCl (хлороводень).
Так само гримучою є суміш водню з киснем (реакція відбувається при наявності ініціатора з розгалуженим ланцюговим механізмом):
О2 + 2H2 = 2H2О.
Під час горіння водню виділяється велика кількість теплоти (Н0298 (Н2Орід) = –285,5 кДж/моль, Н0298 (Н2О пара = –241,8 кДж/моль)), температура водневого полум’я може досягати 2800 оС, тому водень використовують для зварювання і різання металів, у двигунах космічних кораблів і т.д.
З менш активними окисниками (Br2, J2, S) водень взаємодіє при нагріванні:
Br2 + H2 = 2HBr (бромоводень);
H2 + S = H2S (сірководень);
а з азотом – при нагріванні і підвищеному тиску:
N2 + 3H2 2NH3 (аміак).
Водень є сильним відновником і при нагріванні відновлює метали з їхніх оксидів та галогенідів:
PbO + H2 = Pb + H2O;
CuCl2 + H2 = Cu + 2HCl.
Ці реакції використовуються в металургії для отримання вільних металів. Чим активніший метал, тим вища температура потрібна для перебігу реакції відновлення металу із оксиду воднем.
Атомарний водень активніший, ніж молекулярний, тому всі характерні для водню реакції з атомарним воднем відбуваються значно енергійніше. Якщо молекулярний водень відновлює метали із солей лише при нагріванні, то атомарний може відновлювати багато металів з їх солей навіть у водних розчинах.
Утворення молекули водню з його атомів супроводжується значним виділенням теплоти:
Н + Н = Н2 + 435 кДж.
Якщо спрямувати струмінь газу, що містить атомарний водень, на тверде тіло, то за рахунок теплоти, яка виділяється в результаті утворення з атомів Н молекулярного водню, температура тіла зросте до 4000 oC. Цю реакцію використовують для зварювання та різання металів за допомогою спеціальних водневих пальників.
Водень також взаємодіє з органічними речовинами. Реакція взаємодії водню з органічними речовинами називається реакцією гідрогенізації (або гідрування), вона відбувається, як правило, при нагріванні і за наявності каталізатора (наприклад, Pt, Ni).
Реакції приєднання до ненасичених вуглеводнів за місцями кратних зв’язків:
СН2=СН2 + Н2 → СН3–СН3; (етилен (етен) → етан)
СНСН + Н2 → СН2=СН2; (ацетилен (етин) → етен)
С6Н6 + 3Н2 → С6Н12. (бензол → циклогексан)
2. Реакції відновлення :
R–COH + Н2 → R–CH2–OH (альдегід → спирт).
Застосування водню. Застосовується у металургії для відновлення кольорових металів з оксидів (W, Mo, Co, Ni та ін.), для добування хлороводню, метилового спирту, аміаку, низки органічних сполук, для гідрогенізації вуглеводнів, нафти. Водень є перспективним екологічно чистим паливом, оскільки єдиним продуктом його згоряння є чиста вода. Ізотопи Гідрогену – дейтерій і тритій – використовуються в атомній енергетиці. Так, важка вода, D2O, є ефективним сповільнювачем нейтронів в ядерних реакторах.

 a2O
a2O l2O3
l2O3 iO2
iO2