
- •11. Классификация орг. Р-ций
- •12. Строение. Изомерия и номенклатура циклоаканов
- •14.Особ. Пр-ного стр-ния малых и норм. Циклов циклоалк.
- •15.Таория напряж. Байера. Устойчивость циклов
- •18. Окисл., галог., нитрование изобутана
- •19.Химические свойства алкенов: гидрирование, галогенирование, гидратация. Механизмы реакций.
- •20.Химические свойства алкенов: радикальное присоединение по Харашу.
- •21.Полимерация алкенов на примере этилена. Механизм р-ии. Типы полимеризации
- •22.Катализаторы Циглерра-Натта(кат. Виниловой полимерации)
- •23.Строение, номенклатура, изомерия алкадиенов
- •24.Электронное строение сопряжённых диенов. Р-ии восст. И циклоприсоед. Механизмы р-ий
- •26.Окисление и каталитическое гидрирование бут-2-ина.
- •Вопрос 32 Алкилирование аренов по Фриделю-Крафцу. Мех. И продукты р-ий
- •Вопрос 33 р-ии сульфирования аренов на прим. Нитробензола и 1-нитронафталина
- •46.Реакционные центры спиртов и фенолов. Реакции с участием нуклеофильного центра. Механизмы реакций.
- •56.Реакции замещения карбонильного кислорода у альдегидов и кетонов. Механизмы реакций.
- •57. Получение и практическое использование формальдегида, уксусного альдегида, бензальдегида, фурфурола.
- •58.Химические свойства β-дикарбонильных соединений. Механизмы реакций.
- •60.Строение, изомерия, номенклатура карбоновых кислот.
- •61.Специфические реакции карбоновых кислот с участием сложных эфиров, амидов, нитрилов. Механизмы реакций.
- •62. Жиры как сложные эфиры. Строение, биохимическое значение, промышленное использование.
- •3Ch2-o-co-(c17h33)3триастерин(тв. Жир)
- •4) Обменные реакции.
- •63. Строение, изомерия, номенклатура аминов.
- •64. Химические свойства аминов: алкилирование, ацилирование, взаимодействие с азотистой кислотой. Механизмы реакций.
- •65. Строение, изомерия, номенклатура нитросоединений.
- •67. Строение, изомерия, номенклатура аминокислот.
- •68.Химические свойства альфа-аминокислот как бифункциональных нитросоединений. Механизмы реакций.
- •44.Получение спиртов и фенолов. Механизмы
68.Химические свойства альфа-аминокислот как бифункциональных нитросоединений. Механизмы реакций.
Аминокислоты - это орг. амфотерные соед. Они сод. в составе молекулы 2 функц. группы противоп. характера: аминогруппу с осн. свойствами и карбоксильную группу с кисл. свойствами. Аминокислоты реаг. как с кислотами, так и с основаниями:
Н2N-СН2-СООН + HCl→ Сl[Н3N-СН2-СООН],
Н2N-СН2-СООН + NaOH → H2N-CH2-COONa + Н2О.
При р-ии аминокислот в воде карбоксильная группа отщ. ион водорода, кот.может присоед. к аминогруппе. При этом обр. внутр. соль, молекула которой предст. собой биполярный ион:
H2N-CH2—СООН +Н3N-СН2—СОO-.
Кислотно-основные превращения аминокислот в различных средах можно изобразить следующей общей схемой:
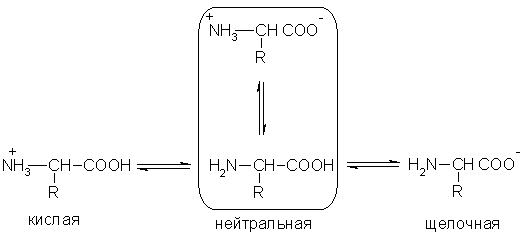
Водные рры аминокислот имеют нейтр., щелочную или кислую среду в зависимости от кол-ва функц. групп. Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин - щелочной (одна группа -СООН, две -NH2).
Подобно первичным аминам, аминокислоты реаг. с азотистой кислотой, при этом аминогруппа превр. в гидроксогруппу, а аминокислота — в гидроксикислоту:
H2N-CH(R)-COOH + HNO2 → HO-CH(R)-COOH + N2↑+ H2O
Измер. объема выдел. азота позволяет опр. Кол-во аминокислоты (метод Ван-Слайка).
Аминокислоты могут реаг. со спиртами в прис. Газообр.о хлороводорода, . сложный эфир (точнее, в хлороводородную соль эфира):
H2N-CH(R)-COOH + R'OH H2N-CH(R)-COOR' + Н2О.
Сложные эфиры аминокислот не имеют биполярной структуры и явл. летучими соед.
Важнейш.свво аминокислот — их способность к конденсации с обр. пептидов. При взаим. 2х аминокислот происх. отщепление гидроксильной группы от карбоксильной и отщепление атома водорода от аминогруппы и в результате образуется вода и дипептид.
При нагревании альфа-аминокислот образуются циклические амиды (дикетопиперазины), построенные из двух молекул альфа-аминокислоты, и 2 молекулы воды.
Качественные реакции.
1) Все аминокислоты окисляются нингидрином с образованием продуктов, окрашенных в сине-фиолетовый цвет. Иминокислота пролин дает с нингидрином желтое окрашивание. Эта реакция может быть использована для количественного определения аминокислот спектрофотометрическим методом.
2) При нагревании ароматических аминокислот с концентрированной азотной кислотой происходит нитрование бензольного кольца и образуются соединения, окрашенные в желтый цвет. Эта реакция называется ксантопротеиновой
41.Классификация спиртов и фенолов.Спирты класс-ся: 1) по стр. ув рад-ла разл-т: а) спирты алифатического (жирного ряда); б) аром-е, которые разд-ся на фенолы Аr-OH и жирноароматические спирты Ar(CH2)n-OH; 2) по числу гидроксилов(ОН) спирты бывают одно-, двух– и многоатомные. Например: а) одноат. спирты СН3-ОН (метанол); б) двухат. спирт HO-CH2-CH2OH (этандиол); в) трехат. спирт НОСН2-СНОН-СН2ОН (глицерин).В завис-ти от хара-а углерод. Ат., при котором нах-ся гидроксил, раз-ют первичные, вторичные и третичные спирты.Классф. по атомности. Одноатомные (олы)С2Н5ОН этанол(этиловый спирт). Двухатомные (диолы) этандиол-1,2(этиленгликоль). Трёхатомные( триолы ) пропантриол-1,2,3(глицерин).В завис-и от того при каком углерод.атоме нах. ОН группа, различают первичные вторичные, третичные спирты.Фенолы-спирты у кот. гидрок.группа связана с аром-им кольцом: одноат.(ареолы ArOH, где Ar-арил,т.е. одновалентный радикал аром-го ув).Двухат.(арендиолы).Трёхат.(арентриолы).
42.Строение, изомерия, номенклатура спиртов.Стру-я изом-я пред-х спиртов опред-ся стр.угл-й цепи и полож. ОН гр. в цепи. Изом-я 2х и 3х ат-х спиртов так же опр.взаим. располож.гидро-х групп. По систем-й номен.назв.присваивают добав.суф. ОН к назв.соотве-го ув . В основе назв.спирта по ИЮПАК лежит наим-ие ув самой длин.ув цепи, наличие же ОН груп. указ-ся окон-ем – ол, с цифрой за ним, указыв. номер ат.углерода, при кот. стоит гидроксил. При этом углер. цепь нумер-ся т.о., чтобы гидроксил имел наимен.номер .Нумер.цепи начинают с того края, к кот.ближе распол-на ОН гр. Первые 2 члена гомол.ряда не имеют из-ров ,относ. к классу спиртов, для остал.алканолов вожможны 2 типа изом-и(в пред. своего класса: изом. цепи(углер.скелета),изомер. положения функц.группы.)Спирты изомерны др. классу соед-й-пр.эфирам(пропанол-метилэтиловый эфир).Строение:ат.углерода нах.в состоянии sp-3 гибри-и. мол. пред-ют собой диполи. Они содер.полярные связи С-Н,С-О,О-Н. Дипольные моменты связей С-О И О-Н направлены в сторону ат.кислорода, поэтому ат. О имеет частичный отр.заряд, а ат. С и Н частичные полож. заряды. Поляр-ть связи О-Н> поляр-ти связи С-О всле-ии большой разницы ЭО кислорода и водорода. Однако поляр-сть и этой связи недостаточна для дисс-и её с обр. ионов Н. Поэтому спирты явл-ся неэлектролитами.
43.Нахождение и биологическая роль в природе, практическое использование метилового спирта, ментола, этиленгликоля, глицерина.— этиленгликоль НОСН2—СН2ОН -вязкае бесцвет. жид-ть, хорошо растворим.в воде и спирте, сладкая на вкус; Важным свойств.его способность сильно понижать темпер.замерз.воды, что широко используется для приготовления антифризов. Сл. эфир Э. и азотной кислоты, т. н. Нитрогликоль — взрывчатое вещество. В ограниченных масштабах Э. прим. также как раств-ль печатных и некоторых др.красок, в произв.чернил и паст для шариковых ручек, в орг. синтезе. Э. токсичен.МЕНТОЛ 2-Изопропил-5-метилциклогексанол-1. Бесцвет. крист.с сильн.запах. перечной мяты и холодящ. вкус. Очень мало растворим в воде, легко - в спирте, эфире, уксусной кислоте, легко - в жирных маслах. Ментол пол. из мятного масла, а также синтет. путем . При втирании в кожу и нанес. на слизи.оболоч.ментол выз. раздражение нерв-х оконч-й, сопров-ся ощущ. холода, легкого жжения и покал-я, оказ. легкое местное обезбол.действ.; Ментол явл.состав.частью целого ряда комбин. гот. лекарст. препаратов и разл.экстемпоральных прописей.ГЛИЦЕРИН, CH2(OH)CH(OH)CH2OH, бесцв.горюч. вязкая жидкость слад. вкуса,. Эфиры глицерина - глицериды - основа жиров. Глицерин - сырье в произв.нитроглицерина, алкидных (глифталевых) смол, смягчитель в кожеве-й, тексти-й, бумаж.пром., компонент пищ., фармаце-их и космет-х прод., антифризов, эмульгаторов. Добыв.из жиров для мед-х, гиги-х и техн-х целей. Глицерин – побочный продукт при произв. стеарина и при мыловарении употреб. для мн.целей: для предохр.от высых.скисания, для подслащи-я вина, для смазки частей машин, для пригот.динамита и т. мЕТИЛОВЫЙ СПИРТ (метанол, древесный спирт), CH3OH, бесцв. горюч.жид-ть со сл. спиртовым запах.,. Сырье в произв. формальдегида, сл.эфиров и др. продуктов; раств-ль. Яд, действую.на нервную и сосудистую системы, прием внутрь 5 - 10 мл может привести к слепоте, а 30 мл - к смерти..
