
- •11. Классификация орг. Р-ций
- •12. Строение. Изомерия и номенклатура циклоаканов
- •14.Особ. Пр-ного стр-ния малых и норм. Циклов циклоалк.
- •15.Таория напряж. Байера. Устойчивость циклов
- •18. Окисл., галог., нитрование изобутана
- •19.Химические свойства алкенов: гидрирование, галогенирование, гидратация. Механизмы реакций.
- •20.Химические свойства алкенов: радикальное присоединение по Харашу.
- •21.Полимерация алкенов на примере этилена. Механизм р-ии. Типы полимеризации
- •22.Катализаторы Циглерра-Натта(кат. Виниловой полимерации)
- •23.Строение, номенклатура, изомерия алкадиенов
- •24.Электронное строение сопряжённых диенов. Р-ии восст. И циклоприсоед. Механизмы р-ий
- •26.Окисление и каталитическое гидрирование бут-2-ина.
- •Вопрос 32 Алкилирование аренов по Фриделю-Крафцу. Мех. И продукты р-ий
- •Вопрос 33 р-ии сульфирования аренов на прим. Нитробензола и 1-нитронафталина
- •46.Реакционные центры спиртов и фенолов. Реакции с участием нуклеофильного центра. Механизмы реакций.
- •56.Реакции замещения карбонильного кислорода у альдегидов и кетонов. Механизмы реакций.
- •57. Получение и практическое использование формальдегида, уксусного альдегида, бензальдегида, фурфурола.
- •58.Химические свойства β-дикарбонильных соединений. Механизмы реакций.
- •60.Строение, изомерия, номенклатура карбоновых кислот.
- •61.Специфические реакции карбоновых кислот с участием сложных эфиров, амидов, нитрилов. Механизмы реакций.
- •62. Жиры как сложные эфиры. Строение, биохимическое значение, промышленное использование.
- •3Ch2-o-co-(c17h33)3триастерин(тв. Жир)
- •4) Обменные реакции.
- •63. Строение, изомерия, номенклатура аминов.
- •64. Химические свойства аминов: алкилирование, ацилирование, взаимодействие с азотистой кислотой. Механизмы реакций.
- •65. Строение, изомерия, номенклатура нитросоединений.
- •67. Строение, изомерия, номенклатура аминокислот.
- •68.Химические свойства альфа-аминокислот как бифункциональных нитросоединений. Механизмы реакций.
- •44.Получение спиртов и фенолов. Механизмы
64. Химические свойства аминов: алкилирование, ацилирование, взаимодействие с азотистой кислотой. Механизмы реакций.
Амины,
явл. произв. аммиака, им. сходное с ним
строение и прояв. подобные ему свва.
Как в аммиаке, так и в аминах атом азота
имеет непод. пару электронов. Поэтому
амины подоб.аммиаку проявл. осн. св-ва,
т.е. явл. орг. основ.Амины не хар-ся ре-ми
нуклеофильного замещ. аминогруппы и
кисл. св-вами. Хим. свва опр. наличием у
атома азота непод. Электр.пары. Амины
выст. в роли нуклеофилов и сильных орг.
основ.Алиф. амины более сильные основ.,
чем аром.1.Алкилирование.
Прот. по мех. нуклеоф. замещ.В кач.
нуклеофила выст. молекула амина. На 1-й
стадии перв. амин превр. во вторичный.
Обр. галогеном водород дает с получ.
амином соотв. аммониевую соль, кот.
взаим. с еще 1-й молекулой перв. амина,
превр. во вторичный.2.Ацилирование.
Пров. ангидридами, хлорангидридаим и
др. функц.произв. карб. к-т. В роли
нуклеофилов выступ. амины. В р-ю
ацилирования вступ. первичные и
вторичные амины, амины, сод. пред.,
непред. и аром.радикалы, третичные амины
не ацилируются, они обр. соли. В общем
виде р-ю ацилирования аминов можно
предст. след. образом:
![]() Очень
вероятно, что р-я ацилирования нач. с
присоед. молекулы ацилирующего агента
к молекуле амина за счет непод. электронной
пары азота и протекает по схеме:
Очень
вероятно, что р-я ацилирования нач. с
присоед. молекулы ацилирующего агента
к молекуле амина за счет непод. электронной
пары азота и протекает по схеме:
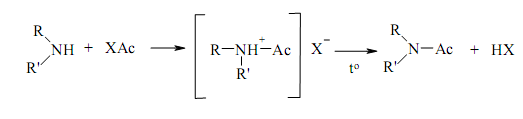 Прод.
ацилирования можно рассм., с одной
стороны, как ацилированный амин, с
др. стороны, как амид к-ты, у кот. атом
водорода замещ. на ув радикал. В рез.
амины превр. в замещ. амиды карб.
к-т.Скорость р-ии ацилирования аминов
зав.от природы как ацилирующего агента,
так и амина. Взаимодействие
с азотистой кислотой.Азотистая
кислота HNO2
- неустойчивое соед. Поэтому она исп.
только в момент выдел.Обр. HNO2,
как все слабые к-ты, действ.на ее соль
(нитрит) сильной ки-той: KNO2
+ HCl = НNO2
+ KCl.Строение прод. Р-ии с HNO2
зав.от х-ра амина. Поэтому данная р-я
исп. для различения первичных, вторичных
и третичных аминов. Важное практ. Знач.
имеет р-я hno2
с перв. аром. аминами. Напр.при р-ии
анилина с HNO2
при пониж. темп. (около 0 °С) обр. соли
диазония кот. исп. в синтезе азокрасителей
и ряда других соед.. При более высокой
темп. р-я идет с выд. азота и анилин
превр. в фенол. Подобно анилину реаг. с
HNO2
и др.перв.е аром. амины.Первичные алиф.
амины c HNO2
обр. спирты. Характ. признаком р-ии явл.
выдел. азота: R-NH2
+ HNO2
= R-OH
+ N2
+ H2O.Первичные
аром. амины при комн. Темп. реаг. Аналог.,
обр. фенолы и выд.азот. При низк. Темп.
(около 0 °С) р-я идет иначе. Вторичные
амины (алифатические, ароматические и
смешанные) под действием HNO2
превр. в нитрозоамины R2N-N=O
– маслообр.вва желтого цвета (нитрозо
– назв. группы -N=O).
R2-N-H+H-O-N=O=>R2N-N=O+H2O.Третичные
алиф. амины при комн. Темп. и низкой
конц. HNO2
с ней не реаг.. Р-я при нагр. Прив. к обр.
смеси прод. и не имеет практ. Знач.Третичные
жирноаром. амины при действии азотистой
кислоты вступают в реакцию электрофильного
замещ. по бензольному кольцу и превр.
в пара-нитрозопроизводные (крист. вва
зеленого цвета).C6H5-N(CH3)2(HNO2)=>O=N-C6H5-N-(CH3)2
Окисление
аминовАмины,
особ.аром., легко окисл. на воздухе. В
отл. от аммиака, они способны воспл.я
от открытого пламени.4 СH3NH2
+ 9 O2
=>4 CO2
+ 10 H2O
+ 2 N2.Р-ии
аминов с участием УВ радикалов.1)
Галогенирование Пример, анилин + бром
=(20̊)=> 2,4,6-триброманилин. 2)
СульфированиеАнилин + Н2SO4
=(200̊, -вода) => сульфаниловая кислота.При
сульфировании анилина сульфогруппа
также ориентируется в пара- положение
и в результате образуется сульфаниловая
кислота.
Прод.
ацилирования можно рассм., с одной
стороны, как ацилированный амин, с
др. стороны, как амид к-ты, у кот. атом
водорода замещ. на ув радикал. В рез.
амины превр. в замещ. амиды карб.
к-т.Скорость р-ии ацилирования аминов
зав.от природы как ацилирующего агента,
так и амина. Взаимодействие
с азотистой кислотой.Азотистая
кислота HNO2
- неустойчивое соед. Поэтому она исп.
только в момент выдел.Обр. HNO2,
как все слабые к-ты, действ.на ее соль
(нитрит) сильной ки-той: KNO2
+ HCl = НNO2
+ KCl.Строение прод. Р-ии с HNO2
зав.от х-ра амина. Поэтому данная р-я
исп. для различения первичных, вторичных
и третичных аминов. Важное практ. Знач.
имеет р-я hno2
с перв. аром. аминами. Напр.при р-ии
анилина с HNO2
при пониж. темп. (около 0 °С) обр. соли
диазония кот. исп. в синтезе азокрасителей
и ряда других соед.. При более высокой
темп. р-я идет с выд. азота и анилин
превр. в фенол. Подобно анилину реаг. с
HNO2
и др.перв.е аром. амины.Первичные алиф.
амины c HNO2
обр. спирты. Характ. признаком р-ии явл.
выдел. азота: R-NH2
+ HNO2
= R-OH
+ N2
+ H2O.Первичные
аром. амины при комн. Темп. реаг. Аналог.,
обр. фенолы и выд.азот. При низк. Темп.
(около 0 °С) р-я идет иначе. Вторичные
амины (алифатические, ароматические и
смешанные) под действием HNO2
превр. в нитрозоамины R2N-N=O
– маслообр.вва желтого цвета (нитрозо
– назв. группы -N=O).
R2-N-H+H-O-N=O=>R2N-N=O+H2O.Третичные
алиф. амины при комн. Темп. и низкой
конц. HNO2
с ней не реаг.. Р-я при нагр. Прив. к обр.
смеси прод. и не имеет практ. Знач.Третичные
жирноаром. амины при действии азотистой
кислоты вступают в реакцию электрофильного
замещ. по бензольному кольцу и превр.
в пара-нитрозопроизводные (крист. вва
зеленого цвета).C6H5-N(CH3)2(HNO2)=>O=N-C6H5-N-(CH3)2
Окисление
аминовАмины,
особ.аром., легко окисл. на воздухе. В
отл. от аммиака, они способны воспл.я
от открытого пламени.4 СH3NH2
+ 9 O2
=>4 CO2
+ 10 H2O
+ 2 N2.Р-ии
аминов с участием УВ радикалов.1)
Галогенирование Пример, анилин + бром
=(20̊)=> 2,4,6-триброманилин. 2)
СульфированиеАнилин + Н2SO4
=(200̊, -вода) => сульфаниловая кислота.При
сульфировании анилина сульфогруппа
также ориентируется в пара- положение
и в результате образуется сульфаниловая
кислота.
