
- •Химические свойства кислот и оснований.
- •Номенклатура и химические свойства солей.
- •Комплексные соединения: номенклатура, состав и химические свойства.
- •Ионообменные реакции с участием осадков и газов.
- •5. Ионообменные реакции с участием слабых электролитов и комплексных ионов.
- •Степень окисления. Окислительно-восстановительные реакции.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием. Степень гидролиза
- •Гидролиз соли, образованной слабой кислотой и сильным основанием.
- •Гидролиз соли, образованной слабой кислотой и слабым основанием.
- •Случаи полного гидролиза.
- •Термохимия. Тепловой эффект реакции. Термохимические уравнения. Закон Гесса.
- •Термохимия. Энтальпия образования реагента. Вычисление теплового эффекта.
- •Химическая термодинамика. Функции процесса и состояния. Энтропия. Энергия Гиббса.
- •Химическая термодинамика. Определение направления протекания реакциипо изменению её энергии Гиббса. Энтальпия образования реагента.
- •Химическое равновесие. Константа равновесия гомогенных и гетерогенных реакций.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия при изменении температуры.
- •Химическое равновесие. Принцип ЛеШателье. Смешение равновесия при изменении общего давления.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия
- •Равновесия в растворах электролитов. Сильные и слабые электролиты.
- •Равновесия в растворах электролитов. Степень иконстанта диссоциации слабого электролита.
- •Равновесия в растворах электролитов. Ионное произведение воды. Водородный показатель.
- •Равновесия в растворах электролитов. Произведение растворимости.
- •Равновесия в растворах электролитов. Константы нестойкости комплексного иона.
- •Химическая кинетика. Зависимость скорости реакции от температуры.
- •Химическая кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность и порядок реакции. Лимитирующая стадия реакции.
- •26 Химическая кинетика применительно к гетерогенным системам.
- •Химическая кинетика. Гомогенный и гетерогенный катализ. Автокатализ.
- •Электрохимия. Уравнение Нернста. Потенциал металлического электрода.
- •Электрохимия. Водородный электрод и ряд напряжений.
- •Электрохимия. Уравнение Нернста.
- •31. Электрохимия. Гальванический элемент.
Термохимия. Тепловой эффект реакции. Термохимические уравнения. Закон Гесса.
Закон Гесса. 1836г - «Тепловой эффект реакции не зависит от пути протекания, а зависит от начальных и конечных состояний системы». Теплота, выделяющаяся или поглощающаяся при протекании реакций – тепловой эффект. Условия: 1)p=const или V=const 2)A’=0 3)Температура исходных веществ должна быть равна температуре продуктов реакции
2)Тепловой эффект реакции, протекающей при стандартных условиях, равен сумме стандартных энтальпий образования продуктов реакции за вычетом стандартных энтальпий образования исходных веществ, с учетом стехиометрических коэффициентов
Согласно закону Гесса, теплота химической реакции равна разности между суммой теплот образования продуктов реакции и суммой теплот образования исходных веществ:
Qреакции = ΣQобр.(продуктов) — ΣQобр.(исх.веществ)
гдеQобр. – теплота образования 1 моль соединения из простых веществ в стандартных условиях (Т = 298 К, p = 101,3 кПа). Величину Qобр. = -ΔHoобр. называют стандартной молярной теплотой (энтальпией) образования вещества. Стандартные теплоты образования простых веществ в наиболее устойчивой модификации (О2, Н2, Сграфит и т.п.) приняты равными нулю.
Закон Гесса позволяет рассчитать тепловые эффекты любых промежуточных (в том числе, гипотетических) стадий на пути превращения реагента в продукт реакции.
Термохимия. Энтальпия образования реагента. Вычисление теплового эффекта.
 - стандартная энтальпия образования
одного моля сложного вещества.
- тепловой эффект образования одного
моля сложного вещества из простых
веществ, находящихся в более устойчивых
агрегатных состояниях при стандартных
условиях.
- стандартная энтальпия образования
одного моля сложного вещества.
- тепловой эффект образования одного
моля сложного вещества из простых
веществ, находящихся в более устойчивых
агрегатных состояниях при стандартных
условиях.
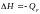
Если реакция происходит при постоянном давлении, то тепловой эффект связан с изменением энтальпии системы:
Q = - ∆H = H1 – H2, где Н1 – общая энтальпия исходных веществ, а Н2 – энтальпия продуктов реакции.
Так как многие химические реакции происходят при постоянном давлении, то под тепловым эффектом обычно понимают изменение энтальпии в химической реакции, ∆H.
Тепловой эффект химической реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ (суммирование проводится с учетом стехиометрических коэффициентов). Для реакции вида aA + bB = cC + dD тепловой эффект равен
H = с *Hобр(С) + d *Hобр(D) - a *Hобр(A) – b *Hобр(B).
Теплота образования Hобр – это тепловой эффект образования одного моля соединения из простых веществ при заданных условиях.
Химическая термодинамика. Функции процесса и состояния. Энтропия. Энергия Гиббса.
Энергия Гиббса (G) – — это величина, показывающая изменение энергии в ходе химической реакции и дающая таким образом ответ на вопрос о принципиальной возможности протекания химической реакциисистемы
ΔG = ΔНр-ции – Т*ΔSр-циигде ΔG - искомая величина, то есть энергия Гиббса ΔНр-ции - изменение энтальпии реакции ΔSр-ции- изменение энтропии реакции Т - температура реакцииΔНр-циии ΔSр-циирассчитываются по закону Гесса то есть изменение энтальпии G = Gкон - Gнач
(Т= H/S) –равновесная температура.
Если G<0, то реакция может протекать самопроизвольно.
Понятие об энтропии.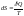 - энтропия. Энтропия – функция состояния,
характеризующая меру неупорядоченности
(хаотичности) системы.
- энтропия. Энтропия – функция состояния,
характеризующая меру неупорядоченности
(хаотичности) системы.
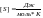 .
.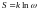 ,
где
,
где
 - термодинамическая вероятность
реализации данного макросостояния.
- термодинамическая вероятность
реализации данного макросостояния.
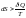 для
необратимых процессов
для
необратимых процессов
где k — коэффициент пропорциональности.
В отличие от других термодинамических функций, можно определить не только изменение, но и абсолютное значение. При абсолютном нуле энтропия идеального кристалла равна нулю. Энтропия растёт по мере повышения температуры.
