
- •Химические свойства кислот и оснований.
- •Номенклатура и химические свойства солей.
- •Комплексные соединения: номенклатура, состав и химические свойства.
- •Ионообменные реакции с участием осадков и газов.
- •5. Ионообменные реакции с участием слабых электролитов и комплексных ионов.
- •Степень окисления. Окислительно-восстановительные реакции.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием. Степень гидролиза
- •Гидролиз соли, образованной слабой кислотой и сильным основанием.
- •Гидролиз соли, образованной слабой кислотой и слабым основанием.
- •Случаи полного гидролиза.
- •Термохимия. Тепловой эффект реакции. Термохимические уравнения. Закон Гесса.
- •Термохимия. Энтальпия образования реагента. Вычисление теплового эффекта.
- •Химическая термодинамика. Функции процесса и состояния. Энтропия. Энергия Гиббса.
- •Химическая термодинамика. Определение направления протекания реакциипо изменению её энергии Гиббса. Энтальпия образования реагента.
- •Химическое равновесие. Константа равновесия гомогенных и гетерогенных реакций.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия при изменении температуры.
- •Химическое равновесие. Принцип ЛеШателье. Смешение равновесия при изменении общего давления.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия
- •Равновесия в растворах электролитов. Сильные и слабые электролиты.
- •Равновесия в растворах электролитов. Степень иконстанта диссоциации слабого электролита.
- •Равновесия в растворах электролитов. Ионное произведение воды. Водородный показатель.
- •Равновесия в растворах электролитов. Произведение растворимости.
- •Равновесия в растворах электролитов. Константы нестойкости комплексного иона.
- •Химическая кинетика. Зависимость скорости реакции от температуры.
- •Химическая кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность и порядок реакции. Лимитирующая стадия реакции.
- •26 Химическая кинетика применительно к гетерогенным системам.
- •Химическая кинетика. Гомогенный и гетерогенный катализ. Автокатализ.
- •Электрохимия. Уравнение Нернста. Потенциал металлического электрода.
- •Электрохимия. Водородный электрод и ряд напряжений.
- •Электрохимия. Уравнение Нернста.
- •31. Электрохимия. Гальванический элемент.
Химическая кинетика. Гомогенный и гетерогенный катализ. Автокатализ.
Химическая кинетика – раздел химии, изучающий скорость химических реакций. Скорость химических реакций зависит от многих факторов, основные из которых - концентрация (давление) реагентов, температура и действие катализатора. Эти же факторы определяют и достижение равновесия в реагирующей системе. П р и м е р 1. Во сколько раз изменится скорость прямой и обратной реакции в системе 2SO2(г) + О2(г) Û 2SO3(г), если объем газовой смеси уменьшить в три раза? В какую сторону сместится равновесие системы? Р е ш е н и е. Согласно закону действия масс скорости прямой и обратной реакции до изменения объема vпр = Ка2 в; vобр = К1 с2, где [ SO2 ] = a; [ O2 ] = в; [ SO3 ] = c. После уменьшения объема гомогенной системы в три раза концентрация каждого из реагирующих веществ увеличится в три раза: [ SO2 ] = 3a; [ O2 ] = 3в; [ SO3 ] = 3c. Отсюда n1п = 27 Ка2 b = 27; n1обр = 9 К1 с2 = 9. nпр Ка2 b nобр К1 с2
Гомогенный и гетерогенный катализ Катализаторы и каталитические системы. Сущность каталитического действия. Гомогенный катализ. Гетерогенный катализ. Методы повышения эффективности технологических процессов за счет использования катализаторов При гомогенном катализе катализатор и реагирующие вещества образуют одну фазу (газовая смесь или раствор). При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах.
Автокатализ — катализ химической реакции одним из её продуктов или исходных веществ. Одним из наиболее широко известных примеров автокатализа является окисление щавелевой кислоты перманганатом калия:
2MnO4− + 5C2O42− + 16H+ = 2Mn2+ + 10CO2 + 8H2O
Катализатором этой реакции являются ионы Mn2+. При комнатной температуре эта реакция вначале протекает медленно, но по мере накопления в растворе продукта-катализатора, она ускоряется.
Электрохимия. Уравнение Нернста. Потенциал металлического электрода.
Электрохимия – естественнонаучная дисциплина, которая изучает физико-химические свойства ионных растворов и расплавов, а также явления, которые протекают на границе раздела фаз с участием заряженных частиц.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Вывод уравнения Нернста
![]() ,
,
где
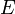 —
электродный потенциал,
—
электродный потенциал, 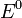 —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;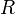 — универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная,
равная 8.31 Дж/(моль·K);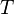 —
абсолютная температура;
—
абсолютная температура;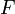 — постоянная
Фарадея,
равная 96485,35 Кл·моль−1;
— постоянная
Фарадея,
равная 96485,35 Кл·моль−1;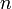 —
число моль электронов,
участвующих в процессе;
—
число моль электронов,
участвующих в процессе;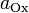 и
и 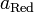 — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если в формулу
Нернста подставить числовые значения
констант ![]() и
и ![]() и
перейти от натуральных
логарифмов к десятичным,
то при
и
перейти от натуральных
логарифмов к десятичным,
то при ![]() получим
получим
![]()
Потенциал металлического электрода может быть стабильным при равенстве числа электронов, подводимых к нему и отводимых от него в единицу времени. [1]
Потенциал металлического электрода, возникающий при его погружении в раствор, содержащий данное вещество в двух различных степенях окисления. [2]
Потенциал металлического электрода, погруженного в раствор с одноименными ионами, представляет собой функцию электролитической упругости растворения металла и концентрации его ионов. Электролитическая упругость растворения характеризует способность данного металла посылать в раствор ионы. Вследствие этого сам металл заряжается отрицательно, так как из него уходят катионы в раствор, а электроны остаются на поверхности. [3]
Потенциалы металлических электродов зависят от активностей ионов металла в ионном проводнике, а потенциалы газовых электродов - от активности ионов реагирующих газов в ионном проводнике и от парциальных давлений этих газов над электролитом. Стандартные электродные по - тенциалы являются мерой окислительно-восстановительной способности металлов и их ионов, газов и их ионов. [4]
Вычислить потенциал металлического электрода относительно электрода сравнения при следующих условиях. [5]
