
- •Предмет химия. Явления химические и физические.
- •Основные понятия и законы химии. Стехиометрические расчеты.
- •Строение атома. Ядерные реакции.
- •Периодический закон и Периодическая система элементов д.И. Менделеева.
- •Характер изменения характеристик атомов химических элементов в Периодической системе.
- •Строение атома. Квантовые числа.
- •Строение многоэлектронных атомов. Правило Клечковского, Хунда. Принцип Паули.
- •Общие представления о химической связи. Основные типы химической связи.
- •Ковалентная связь и ее основные характеристики.
- •Ионная и металлическая связь. Особенности физических свойств соединений с этими типами химической связи.
- •Водородная связь и ее влияние на физические свойства соединений.
- •Межмолекулярное взаимодействие, его природа и типы.
- •Кристаллохимия. Основные типы кристаллических решеток. Структурные типы соединений Ax, By, Cz.
- •Структурные типы соединений Ax, By.
- •Способы выражения состава раствора.
- •Растворимость. Факторы, влияющие на растворимость различных соединений. Механизм образования растворов.
- •Химическая реакция
- •Ионное произведение воды. PH. Расчет pH для растворов сильных и слабых электролитов.
- •Буферные растворы и расчеты их pH.
- •Гидролиз. Различные варианты гидролиза. Факторы, влияющие на степень гидролиза.
- •Электролитические диссоциации. Сильные и слабые электролиты. Закон разбавления Оствальда.
- •Дисперсные системы. Классификация дисперсных систем. Особые свойства дисперсных систем.
- •Коллоидные растворы. Особые свойства коллоидных растворов.
- •Агрегационная устойчивость коллоидных растворов.
- •Поверхностное натяжение. Краевой угол смачивания.
- •Устойчивость коллоидных растворов. Коллоидные растворы в природы.
- •Адсорбция. Типы адсорбентов.
- •Мономолекулярная адсорбция. Изотерма мономолекулярной адсорбции Ленгмюра.
- •Химическая кинетика. Закон действующих масс. Уравнение Аррениуса.
- •Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость гомогенных и гетерогенных реакций.
- •Химическое равновесие. Смещение химического равновесия. Принцип Ле Шателье.
- •Энтропия системы и ее изменение в различных процессах. Энергия Гиббса как критерий протекания химических процессов.
- •Основные законы термохимии и термохимические расчеты.
- •Степень окисления. Окислители и восстановители. Окислительно – восстановительные реакции.
- •Окислительно-восстановительный потенциал полуреакций. Уравнение Нернста.
Способы выражения состава раствора.
Раствором называется однородная устойчивая во времени система состоящая из 2х или более в-в. Р-ры могут быть во всех 3 агригатных состояниях.
Массовая доля – отношение массы растворенного вещества к массе раствора ω(в-ва) = m(в-ва)/m(р-ра).
Объемная доля – отношение объема газа к объему всей смеси газов φ(газа) = V(газа)/V(смеси).
Мольная доля – отношение количества вещества в сумме количеств вещества и растворителя χ(в-ва) = n(в-ва)/(n(в-ва)+n(р-ра)).
Молярная концентрация (млярный 2М)– отношение количества растворенного вещества к объему раствора С(в-ва) = n(в-ва)/V(р-ра) (моль/л).
Молярная концентрация эквивалента (нормальный 2н)
С( =n(
=n( /V(р-ра)
(моль-экв/л)
/V(р-ра)
(моль-экв/л)
С(х)=
С(
/
Растворимость. Факторы, влияющие на растворимость различных соединений. Механизм образования растворов.
Раствором называется однородная устойчивая во времени система состоящая из 2х или более в-в. Р-ры могут быть во всех 3 агригатных состояниях.
По
степени дробления: истинные(отдельные
молекулы или ионы) и коллоидные(частицы
от
 до
до
 м)
м)
По насыщению: насыщенные(р-р который нах-ся в равновесии с фазой растовряемого), ненасыщенные и пересыщенные(содержание растворенного в-ва больше чем в насыщенном).
Растворимость – способность вещества растворяться в том или ином растворителе.
Факторы, влияющие на растворимость:
Природа растворителя и природа растворимого вещества (подобное растворяется в подобном).
Температура. 1) Растворенное вещество газ и для газов с увеличением температуры растворимость уменьшается, а при температуре кипения равна 0. 2) Если рассматривать жидкие и твердые вещества, то с увеличением температуры растворимость увеличивается.
Давление. 1) Для газов с увеличением давления растворимость увеличивается. 2) Жидкости и Твердые вещества. Если давление не высокое, то давление не влияет на растворимость. При очень высоких давлениях 20 – 100 тыс. атмосфер происходит растворение.
Химическая реакция
Ионное произведение воды. PH. Расчет pH для растворов сильных и слабых электролитов.
Ионное произведение воды - произведение концентраций ионовводорода Н+ и ионов гидроксила OH− в воде или в водных растворах. Вода – слабый электролит
Кислотность одна из важных хар-к водных р-ров – рН. По определению рН – это отрицательный десятичный логарифм из активности ионов водорода. Активность – это величина пропорциональная концентрации, поэтому
![]() .
.
Сильные электролиты – все кислоты и основания, константы, ионизации которых больше 10–2.
Слабые электролиты – кислоты и основания, константы, ионизации которых меньше 10–4.
Неэлектролиты – не проводят эл ток. К ним относится больш-во органический соединений(СН4, С6Н6, СН3ОН), простые в-ва неМе(О2, Н2).
Электролиты – проводят ток. Кислоты(Н2SО4), щелочи (КОН, Ва(ОН)2), бол-во солей (КСl, Na3PO4).
Буферные растворы и расчеты их pH.
Буферные растворы— растворы с определённой устойчивой концентрацией водородных ионов; смесь слабой кислоты и её соли (напр., СН3СООН и CH3COONa) или слабого основания и его соли (напр., NH3 и NH4CI). Величина рН буферного раствора мало изменяется при добавлении небольших количеств свободной сильной кислоты или щёлочи, при разбавлении или концентрировании.
Значение
pH буферного раствора можно рассчитать
по формуле:  ,
где pK
это отрицательный десятичныйлогарифм от
константы диссоциации кислоты HA.
,
где pK
это отрицательный десятичныйлогарифм от
константы диссоциации кислоты HA.
По
сути
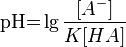 .
.
