
- •Вопрос 4
- •Вопрос 5
- •7.Вопрос
- •8.Вопрос
- •9 Вопрос
- •10 Вопрос
- •11Вопрос
- •12 Вопрос
- •13 Вопрос.
- •14 Вопрос.
- •15 Вопрос.
- •16Вопрос
- •17.Вопрос
- •21Вопрос
- •22.Вопрос
- •23 Вопрос
- •24.Вопрос
- •29.Вопрос
- •30. Вопрос
- •35.Вопрос
- •36. Вопрос
- •40.Вопрос
- •41. Вопрос
- •42Вопрос
- •43Вопрос
- •44.Вопрос
- •47.Вопрос
- •49.Вопрос
10 Вопрос
.Адсорбция на границе твердое тело – газ. Теория мономолекулярной адсорбции Ленгмюра. Вывод и анализ ур-я изотермы мономолекулярной адсорбции Ленгмюра.
Адсорбция-это самопроизвольное концентрирование вещ-ва на границе раздела фаз.
Адсорбент-это вещ-во которое концентрирует на своей пов-ти др.вещ-во, адсорбированное вещ-во-адсорбат. Тв адсорбенты - это природные и искусственные материалы с большой наружной или внутренней пов-тью, на которой происходит адсорбция из граничащих с ней газов или растворов. Различают физическую и химическую адсрбцию. Физич адсорбция явл обратимой,т.е. при опр-ых условиях молекулы абсорбата могут покидать пов-сть адсорбента- десорбция. Интенсивность десорбции возраст с увелич темпер. Химич адсорбция обычно не обратима, т.к. молекулами адсорбата и адсорбента возникают хим связи. Адсорбция на границе тв тело-газ: процесс концентриров молекул газовой фазы на пов-сти тв.адсорбента.
Теория Ленгмюра:
1.Процесс адсорбции явл обратимым и его можно рассматривать как обратимую квазехимическую реакцию.
2.Молекулы адсорбата адсорбируются на активных центрах тв.пов-сти имеющих избыточную повер-ую энергию(шероховатость,скол)
3.Молекулы адсорбата образуют на пов-сти адсорбента мономолекулярный слой.
Псевдохимич реакция
процесса адсорбции имеет вид: молекула
газа + «активный центр» ⇌(над
стрелкой адсорбц, под стрел десорбция)
адсорбционный комплекс ∆Н˂0 (энтальпия).
При увелич темпер возрастает обратный
процесс – десорбция р + а₀
⇌
а, где а₀-концентр
актив центров на ед пов-сти, а- кол-во
адсорбированного в-ва, р- давление.
 = а/р*а₀. а₀=
= а/р*а₀. а₀= – а.
-мах
кол-во адсорбата способное разместиться
на единице пов-сти адсорбента.
– а.
-мах
кол-во адсорбата способное разместиться
на единице пов-сти адсорбента.
= а/р( -а) а= *р( -а) а= *р* - *р*а а+ *р*а = *р*
а(1+ *р)= *р* а=( *р* )/(1+ *р) – ур-е адсорбции Ленгмюра
Проанализ зависимость:
1) при малых значениях р ур-е приним вид а= *р*
2)если >>1 адсорбция будет предельной а≈
а
а=
р
П ри
пов-сть адсорбента покрыта сплошным
слоем адсорбированных молекул (на верху
– монослой, внизу - адсорбент)
ри
пов-сть адсорбента покрыта сплошным
слоем адсорбированных молекул (на верху
– монослой, внизу - адсорбент)
11Вопрос
. Линейная форма ур-я Ленгмюра. Нахождение констант ур-я Ленгмюра графическим методом. Опред-е удельной пов-сти адсорбента.
р + а₀ ⇌ а, где а₀-концентр актив центров на ед пов-сти, а- кол-во адсорбированного в-ва, р- давление. = а/р*а₀. а₀= – а. -мах кол-во адсорбата способное разместиться на единице пов-сти адсорбента.
= а/р( -а) а= *р( -а) а= *р* - *р*а а+ *р*а = *р*
а(1+ *р)= *р* а=( *р* )/(1+ *р) – ур-е адсорбции Ленгмюра
Проанализ зависимость:
1) при малых значениях р ур-е приним вид а= *р*
2)если >>1 адсорбция будет предельной а≈
а
а=
р
П ри
пов-сть адсорбента покрыта сплошным
слоем адсорбированных молекул (на верху
– монослой, внизу - адсорбент)
ри
пов-сть адсорбента покрыта сплошным
слоем адсорбированных молекул (на верху
– монослой, внизу - адсорбент)
12 Вопрос
. Изотерма полимолекулярной адсорбции. Теория БЭТ. Основные предпосылки, вид ур-я, его анализ и решение.
Основные положения БЭТ:
1.На повер-ти адсорбента имеется опред-ое число равноценных в энергетич отношении активн центров способных удерживать молекулу адсорбата.
2.Взаимодействие соседних адсорбир молекул в первых и последн слоях пренебрегают.
3 .Каждая
молекула 3-го слоя представл собой
возможн центр для образ-я адсорбционного
слоя
.Каждая
молекула 3-го слоя представл собой
возможн центр для образ-я адсорбционного
слоя
Г
В
А
О С
Нижняя часть кривой от начала координат до т.А соотв.изотерме адсорбции Ленгмюра т.е.образов мономолекулярного слоя. Затем происходит полимолекулярная адсорбция и на изотерме наблюд дальнейший подъем кривой(участ АВ). S- образная изотерма указыв на то что адсорбция не останавл на образов мономолекулярного слоя и продолж до образования полимолекулярного слоя. теор БЭТ применима в случае адсорбции газов и паров на тв. пов-сти.
Часто процесс адсорбции заканчивается образованием на поверхности адсорбента не одного слоя молекул адсорбата, а полимолекулярного адсорбционного слоя
Основные положения теории Поляни:
1. на поверхности твердых адсорбентов существуют адсорбционные силы, действующие на расстояниях, превышающих размеры молекул адсорбата, в результате чего образуется полимолекулярный слой;
2.плотность слоя убывает по мере удаления от поверхности адсорбента.
3.адсорбция вызвана чисто физическими силами.
4.плотность слоя однородна,т.е.на ней нет активных центров
5.адсорбционные силы не зависят от температуры,т.е.с измен темпер не меняется адсорбционный объем
Адсорбированная фаза — цепи молекул, первая из которых связана с поверхностью адсорбента. Цепи энергетически не взаимодействуют между собой
Г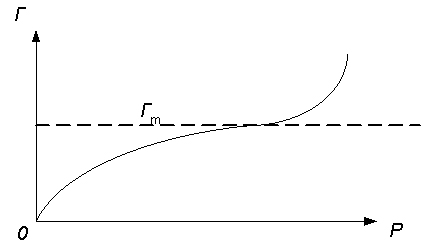 m-предельная
величина полимолекулярн адсорбции
m-предельная
величина полимолекулярн адсорбции
