
- •Вопрос 4
- •Вопрос 5
- •7.Вопрос
- •8.Вопрос
- •9 Вопрос
- •10 Вопрос
- •11Вопрос
- •12 Вопрос
- •13 Вопрос.
- •14 Вопрос.
- •15 Вопрос.
- •16Вопрос
- •17.Вопрос
- •21Вопрос
- •22.Вопрос
- •23 Вопрос
- •24.Вопрос
- •29.Вопрос
- •30. Вопрос
- •35.Вопрос
- •36. Вопрос
- •40.Вопрос
- •41. Вопрос
- •42Вопрос
- •43Вопрос
- •44.Вопрос
- •47.Вопрос
- •49.Вопрос
43Вопрос
правил коагуляции:
1.Любые электролиты могут вызвать коагуляцию, однако заметное воздействие они оказывают при достижении определенной концентрации. ^ Порог коагуляции , моль/л; иногда С– минимальная концентрация электролита, вызывающая коагуляцию (к ). Порог коагуляции определяют по помутнению, изменению окраски или по началу выделения дисперсной фазы в осадок.
Правило Шульце-Гарди (правило значности, эмпирическое): Коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду потенциалопределяющих ионов мицеллы (гранулы), причем, коагулирующее действие тем сильнее, чем выше заряд.
 где
К – коагулирующая способность (примем
ее за единицу).
По
правилу Шульца – Гарди значение порогов
коагуляции для противоионов с зарядами
1, 2 и 3 соотносятся как 1:1/20:1/500, т.е. чем
выше заряд, тем меньше требуется
электролита, чтобы вызвать
коагуляцию.
Например,
коагулируем золь сульфида мышьяка
(As2S3):
или Fe(OH)2
(A
где
К – коагулирующая способность (примем
ее за единицу).
По
правилу Шульца – Гарди значение порогов
коагуляции для противоионов с зарядами
1, 2 и 3 соотносятся как 1:1/20:1/500, т.е. чем
выше заряд, тем меньше требуется
электролита, чтобы вызвать
коагуляцию.
Например,
коагулируем золь сульфида мышьяка
(As2S3):
или Fe(OH)2
(A s2S3)
Fe(OH)2
NaCl
(Na+=5
моль/л)
KBr (Br-=12,5)
MgCl2 (Mg2+=0,72
K)
2SO4 (SO42-=0,205)
AlCl3 (Al3+=0,092)
Правило
Шульце – Гарди имеет приближенный
характер и описывает действие ионов
лишь неорганических соединений.
s2S3)
Fe(OH)2
NaCl
(Na+=5
моль/л)
KBr (Br-=12,5)
MgCl2 (Mg2+=0,72
K)
2SO4 (SO42-=0,205)
AlCl3 (Al3+=0,092)
Правило
Шульце – Гарди имеет приближенный
характер и описывает действие ионов
лишь неорганических соединений.
В ряду органических ионов коагулирующее действие возрастает с повышением адсорбционной способности.
В ряду неорганических ионов одинаковой зарядности их коагулирующая активность возрастает с уменьшением гидратации. Лиотропные ряды или ряды Гофмейстера – это порядок расположения ионов по их способности гидратироваться (связывать воду). Слово ''лиотропный'' значит ''стремящийся к жидкости'' (более подходящий термин для случая водных сред – гидротропный). в
 озрастание
коагулирующей активности
Li+;
Na+;
K+;
Rb+;
Cs+
в
озрастание
коагулирующей активности
Li+;
Na+;
K+;
Rb+;
Cs+
в озрастание
степени гидратации
Теплота
гидратации: 140 117 93 86 (ккал/г-ион)
5.
Очень часто началу коагуляции
соответствует снижение дзета-потенциала
до критического значения (около 0,03
В).
6.
В осадках, получаемых при коагуляции
электролитами, всегда присутствуют
ионы, вызывающие ее.
озрастание
степени гидратации
Теплота
гидратации: 140 117 93 86 (ккал/г-ион)
5.
Очень часто началу коагуляции
соответствует снижение дзета-потенциала
до критического значения (около 0,03
В).
6.
В осадках, получаемых при коагуляции
электролитами, всегда присутствуют
ионы, вызывающие ее.
44.Вопрос
концентрационная и нейтрализационная коагуляция.
Теория ДЛФО ( Дерябин,Ландау,Фервей,Овербек). По современным представлениям взаимодействие коллоидных частиц и процесс коагуляции объясняется тока электростатич. Эффектами. Различают 2 механизма. Нейтрализационная коагуляция для систем в которых гранулы содержат слабоадсорбир.ионы, в слое противоионов. Если в такую систему добавить электролит, который ионы большого заряда, то эти ионы замещают противоиноны адсор.иона. при этом общий заряд противоинов увели-ся,что приводит к нейтрализации слоя потенциал опред.иона. это приводит к уменьшению электрокинетического потенциала,т.е нейтрализации электрического заряда гранул. Нейтрализационная коагуляция яв-ся необратимой,образуется устойчивый осадок.
Концентрационная коагуляция. Наблядается для частиц, которые содержат сильно адсорбир ионы в слои противоинов. В этом случае одноименно заряженные ионы добав электролита, благодаря электростатич.отталкиванию вдавливают противоионы ближе к поверхности тверой фазы, уменьшая при этом общую толщину 2-го электрического слоя, при этом 1-ый электрический слой оказывается за линией скольжения,т.е. электрокинет. Потенциал становится = 0. Выпадает осадок, содерж гранулы и коагулир-щие ионы. Если этот осадок осторожно промыть то из него удаляются коагулир ионы, при этом гранулы приобретают заряд и осадок раствора с образ золя.
45. набухание и
растворение полимеров. Набухание- это
самопроизвольный процесс поглощения
ВМС низкомолекулярной жидкости,
приводящий к значительному увеличению
массы и объема взятого образца:
 m0-масса
исход, m-
масса набухания.
m0-масса
исход, m-
масса набухания.
Давление набухания - это значительное давление возникшее при препятствовании увелич объема
Набухание – это коллоидно-химич процесс, а не физический. Выделяется теплота набухания. Происходит контракция – явление уменьшения общего объема системы. Набухание носит избирательный характер,т.е. наблюдается только в жидкостях с близким к ВМС хим строением.
Стадии набухания:1.
Небольшое кол-во полярных молекул р-ля
взаимод-ют с полярными группами ВМС.
Выделяется теплота набухания Qпроцесс
сопровож-ся контракцией системы, хар-тся
небольшим значением степени набухания
α. При этом выдел-ся теплота будет
рассчитывается:

2стадия. Наблюдается прекращение теплоты и контракции. Происходит основное увеличение объема и массы полимера.
Термодинамическая трактовка процесса: процесс набухания идет самопроизвольно.
Т = const, P=const. ΔG = ΔH-TΔS, ΔG<0.
1стадия: ΔH < 0, ΔS ≈ 0 →| ΔH |> | TΔS | → ΔG<0
2 стадия: ΔH≈ 0, TΔS< 0 → ΔG<0. Эта стадия обусловлена энтропиным фактором.
Факторы влияющие на степень и скорость набухания: тем-ра, рН, давление, степень измельчения, возраст вещества, присутствие электролита.
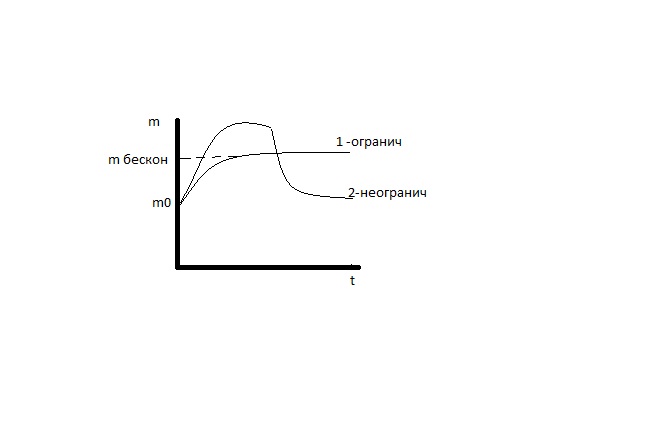
Различают неограниченное и ограниченное набухание. При неограниченном набухании высокополимер сначала поглощает жидкость, а затем, при той же темп-ре, постепенно растворяется, образуя однофазную, гомогенную систему. Ограниченное набухание характеризуется наличием определенного предела, до к-рого высокополимер поглощает жидкость, вне зависимости от времени. При повышении темп-ры нек-рые ограниченно набухающие полимеры растворяются в жидкостях (желатина). Высокополимеры, имеющие пространственную структуру, набухают ограниченно, образуя в набухшем состоянии студни. Желатина при комнатной температуре набухает в воде ограниченно, а при повышении температуры - неограниченно.
46. Аэрозоли. Это воздушные системы,жидкость в газе, твердое в-во в газе.свойства аэрозолей: 1) оптические – подчиняются уравнению Рэлея. Аэрозоли с крупными частицами в основном отражают или поглощают свет. Аэрозоли с мелками частиц преломляют или рассевают.
2) электрич. На поверхности частиц аэрозоля не образуется двойной электрич слой, поэтому электрический заряд аэрозоля яв-ся спонтанным и по величине и по знаку. Экспериментально установлено, что аэрозоли металлов и их оксидов, положит электрический заряд частиц аэрозоля приобретают либо в результате произвольной адсорбции либо в результате возник поверх зарядов в процессе диспергирования частиц.3) термофорез - это движение частиц аэрозоля из теплой области в более холодную, эффект объясняется тем, что энергия газа в теплой зоне больше,чем энергия молекул газа наход-ся в холодной зоне.
4. фотофорез – это движение частиц дисперсионной фазы под действием света. Прямой фотофорез это движение частиц по направлению святого потока. Наблюдается для непрозрачных частиц и объясняется локальным нагревом стороны частиц, обращенной к свету, это приводит к образованию местного термофареза.
5) обратный электрофарез. Это движение частиц аэрозоля навстречу свтовому потоку. Наблюдается для прозрачных частиц и объясняется нагревом дальней стороны частицы в результате преломления или отражения света.
6)термопреципитация. Это осаждение мельчайших частиц аэрозоля на холодной поверхности. Эффект объясняется тем, что частица аэрозоля при соприкосновении с холодной поверхностью понижает свою темпер-ру и след-но уменьшается хим энергия. При этом частица не обладает уже досточной кинетической энергией для отскока от твердой поверхности и поэтому осаждается на ней. эффект используется для сверх тонкой очистки газов от мельчайших частиц газа.
