
- •Вопрос 4
- •Вопрос 5
- •7.Вопрос
- •8.Вопрос
- •9 Вопрос
- •10 Вопрос
- •11Вопрос
- •12 Вопрос
- •13 Вопрос.
- •14 Вопрос.
- •15 Вопрос.
- •16Вопрос
- •17.Вопрос
- •21Вопрос
- •22.Вопрос
- •23 Вопрос
- •24.Вопрос
- •29.Вопрос
- •30. Вопрос
- •35.Вопрос
- •36. Вопрос
- •40.Вопрос
- •41. Вопрос
- •42Вопрос
- •43Вопрос
- •44.Вопрос
- •47.Вопрос
- •49.Вопрос
35.Вопрос
Зависимость толщины ДЭС и электрокинетического потенциала от концентрации и природы противоионов индифферентного электролита. Изоэлектрическая точка, перезарядка. Поскольку электрокинетический потенциал в некоторых случаях является величиной, характеризующей устойчивость коллоидной системы, весьма важно рассмотреть влияние на него таких факторов, как введение в систему электролитов, изменение рН, концентрации р-ра, температуры. Влияние различных факторов на потенциал целесообразно начать с введения в систему индифферентных электролитов, т.е. электролитов, не имеющих ионов, способных достраивать кристаллическую решетку коллоидной частицы. Именно введением индифферентных электролитов на практике чаще всего пользуются для коагуляции коллоидных систем. Индифферентные электролиты не могут сколько-нибудь существенно изменить общий скачок потенциала кол.частиц, а электрокинетический потенциал такие электролиты в общем случае снижают в результате увеличения концентрации противоионов и сжатия ДЭС. При введении Индифферентных электролитов следует различать 2 случая: 1) в систему вводится электролит, один из ионов которого одинаков с противоионами, 2) в систему
вводится электролит, не имеющий общих ионов с электролитом – стабилизатором. При разбавлении всякой коллоидной системы электрокин. потенциал должен возрастать, т.к.толщина ДЭС увеличивается в результате уменьшения концентрации противоионов в р-ре. Вместе с тем при разбавлении может наблюдаться десорбция потенциалопределяющего иона с поверхности Д,Ф., что должно приводить к падению электрокинетич. потенциала. Десорбция — уменьшение концентрации компонента в поверхностном слое вещества (на границе раздела фаз) по сравнению с ее значением в каждой объемной фазе. Процесс, обратный адсорбции. Концентрирование коллоидной системы обуславливает прямо противоположное действие. В каком направлении в итоге изменяется потенциал при изменении концентрации кол. системы, определяется тем, влияние какого из 2-х факторов – сжатия ДЭС или десорбции потенциалопред. ионов в данном конкретном случае окажется сильнее.
36. Вопрос
Строение ДЭС. Количественная модель Гуи-Чепмена
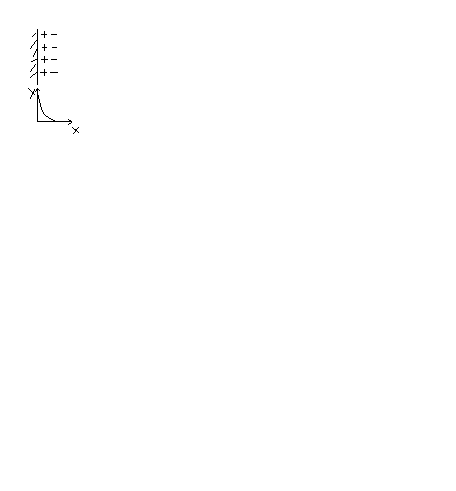
Теория Гельгольца-Перрена. ДЭС плоск.конденсатор, одна обкладка кот-го связан непосред-но с повер-тью тв.тела, а др.обкладка несущая противополож.заряд нах-ся в ж-ти на оч.маленьк.расст-ии от первой обкладки.
 На
поверх-ти частиц адсорб-ся …, кот.сообщ-т
поверх-ти свой заряд под возд-м
электростатит.сил притяж-я, ионы
противопол.знака стрем-ся распол-ся как
можно ближе к ионам 1-го слоя. Потенциал
падения в таком плоском плотном слое
выраж-ся прямой линией.
На
поверх-ти частиц адсорб-ся …, кот.сообщ-т
поверх-ти свой заряд под возд-м
электростатит.сил притяж-я, ионы
противопол.знака стрем-ся распол-ся как
можно ближе к ионам 1-го слоя. Потенциал
падения в таком плоском плотном слое
выраж-ся прямой линией.
 Теория
Гуи-Чепмена. Противоионы не могут быть
сосред-ны только у межфазн.поверх-ти и
образ-ть монослой. ДЭС приобр-т
диф.строение. потенциал падает по кривой
линии.
Теория
Гуи-Чепмена. Противоионы не могут быть
сосред-ны только у межфазн.поверх-ти и
образ-ть монослой. ДЭС приобр-т
диф.строение. потенциал падает по кривой
линии.
 Теория
Штерна. Соврем.теория. по соврем.представл-м
ДЭС имеет след.стр-ру.
Теория
Штерна. Соврем.теория. по соврем.представл-м
ДЭС имеет след.стр-ру.

Слой I. Сплошн.слой потенциалоопред-щих ионов. Слой образ-ся в рез-те избират.ионной адсорбции,т.е. на поверх-ти тв.фазы избир-но адсорб-ся только те ионы, кот.сходны по хим.природе с ионами входящими в состав тв.фазы.
Слой II. Слой противоионов адсорб-го слоя. Ионы закрепл-ся на поверх-ти тв.фазы не только электростатит.притяжением, но и в рез-те сил адсорбции. Слой I и II прочно закреп-ся на поверх-ти тв.фазы, образуя устойч.стр-ру. Слой II лишь частично компенс-т эл.заряы Слой I. Образующая стр-ра имеет опред.эл.заряд.
Слой III. Противоионы диф.слоя. Притяг-ся к образующейся стр-ре только в рез-те электростат.взаимод-ия, т.к это взаим-ие не велико, то слой III явл-ся «размытым», т.к противоионы нах-ся в пост.тепло.движении и могут удал-ся от поверх-ти тв.фазы.
Линия АВ-линия скольжения жид-ти. Слой жид-ти м/у линией скольж-я и тв.фазы явл-ся неподвижным. За линией скольж-ия жид-ть перемещ-ся в рез-те конвекции, т.к линия АВ разрыв-т ДЭС, то м/у неподвижн.тв.фазой и движущейся жид-тью происх-т разделение эл.зарядов и возникает разность эл.потенциалов – электрокинетич.потенциал.
38.вопрос Агрегативн. и седиментац.устойчивость кол.систем. стабилизаторы, их роль в придании кол.системе временной агрегативной устойчивости.
Эмульсии, как и все кол. и микрогетероген.системы, агрегативно неустойчивы из-за избытка своб.энергии на межфаз.поверх-ти. Агрегативн.неустойчивость эм.проявл-ся в самопроизвольном образовании агрегатов капелек с последующим слиянием(коалесценцией) отдельных капелек друг с другом. Это приводит к полному разрушению эмульсии и разделению ее на 2 слоя.(д.ср и д.ф).
Агрегат.устойчивость харак-т либо скоростью расслаивания эм, либо продолжительностью существов-ия(временем жизни) отд.капелек в контакте друг с другом или межфазной поверх-тью.
На агрег.устойч-ть сильнее всего влияют природа и содержание в системе эмульгатора. Эмульгаторы – в-ва, обеспечивающие усточ-ть эм. 1.Жидк.эмульг-ры – ПАВ, мол-лы кот-х распол-ся на границе раздела фаз и искл-т процесс слипания капель эмульсий. Тип образующихся эм.опред-ся струк-ой мол-л ПАВ(длиной УВ-радикала и размером, зарядом полярных групп).


Мол-лы ПАВ с коротк.УВ-радикалом и больш.полярн.группой способ-т образованию прямых эм-ий. В сист.2 больше силы электростат.отталкив-ия м/у полярн.гр.поэтому сист.2 менее устойчива чем сист.1.
Мол.ПАВ с длин.УВ-радикалом способ-т образов-ю обр.эм-ий. Сист.4 более устойчива, чем сист.3 из-за проявления энтропийного ф-ра. Обычно конц-ии ПАВ в устойч.эм-х меньше 0,1%.
2.Тв.эмульгаторы – высок.дисп.порошки, размер частиц кот-х намного меньше капель эмульсии. Частицы порошка образ-т у поверх-ти капель эм.защитную «броню», кот-я препят-т слипанию капель. Полярность эмульг-ра способ-т образ-ию эм-ий опред.типа.
Гидрофильными явл-ся порошки глинян., белая сажа; гидрофобн- различн.сажи.

Из рис.следует, что энергетич.более устойч-ми явл-ся эм-ии, в кот.тв.эмульг-ры распол-ся на внешн.поверх-ти капли эм-сии со стороны д.ср, т.е гидрофильн.эмульг-ры способ-т образ-ию прямых эм-сий, а гидрофобн.-обратных.
39. Факторы устойчивости кол.систем.
Физич.теория устойчивости: при увеличении конц-ии прибавляемого электролита высота энергетич.барьера уменьш-ся на пути сближения частиц золя, увелич-ся доля эффект-х сближений частиц, возникает агрегация, наблюд-ся размытость порога коагуляции.
Кол.защита – явление повышения устойч-ти системы, при введении в золь ВМС и образов-ия на поверх-ти частиц соот-щего адсорбц.слоя. ВМС: белки, углеводы, пиктины, каучук.
Отличия защитн.золей от обычных: 1) их можно концентр-ть; 2)электрофорретич.подвижность защит-го золя электрофорретич.подвижности ВМС; 3)не подчин-ся правилу Шульце-Гарди; 4)реагент, способный осаждать защитн.в-во дейст-т и на защищенную золь.
Зигмонди ввел понятие «золотое число». Это число мг ВМС, кот-е необх-мо добавить к 10мл красн.золя золота для того, чтобы предотвратить его посинение при введении в систему 1мл 1-%-го р-ра NaCl.
