
- •Чаще всего работаем с молярной теплоёмкостью!
- •21)Работа при изменении объема. Первое начало термодинамики. Формула Майера. Применение первого начала термодинамики к изопроцессам идеального газа.
- •Изотермический процесс
- •23)Применение первого начала термодинамики к адиабатическому процессу. Уравнение Пуассона.
- •24) Содержание второго и третьего начала термодинамики
- •25)Распределение молекул во внешнем потенциальном поле сил. Барометрическая формула. Распределение Больцмана.
- •26)Распределение молекул идеального газа по скоростям. Распределение Максвелла. Вычисление средней арифметической, средней квадратичной и наиболее вероятной скоростей.
- •27) Среднее число столкновений молекул идеального газа в единицу времени. Средняя длина свободного пробега молекул идеального газа.
- •28) Явления переноса. Формальное уравнение явлений переноса. Диффузия, внутренне трение, теплопроводность. Физическое истолкование и единицы измерения коэффициентов переноса.
- •31)Электрическое поле. Электрический заряд и его свойства. Закон Кулона.
- •32)Вектор напряженности электрического поля. Поле точечного заряда (шара). Принцип суперпозиции полей. Графическое изображение электрических полей.
- •33)Поток вектора напряженности электрического поля. Теорема Гаусса в электростатике и ее применение для расчета электрических полей. Поле бесконечно заряженной плоскости.
- •34)Теорема Гаусса в электростатике и её применение для расчета поля, создаваемого двумя параллельными бесконечными однородно заряженными плоскостями, поле линейно распределённого заряда.
- •35)Теорема Гаусса в электростатике и её применение для расчета полей, поле заряженной сферы и заряженного шара
- •2. Электростатическое поле шара.
- •36)Работа по перемещению заряда в электрическом поле. Потенциал электрического поля. Разность потенциалов. Потенциал поля точечного заряда (шара).
- •37)Потенциал поля, созданного системой зарядов. Связь между напряженностью и потенциалом. Градиент потенциала. Эквипотенциальные поверхности.
- •40)Энергия электростатического поля. Объемная плотность энергии.
- •41) Электрический диполь. Напряжённость и потенциал, поля диполя.
- •42)Поведение диполя в однородном и неоднородном электрическом поле.
- •44)Сегнетоэлектрики. Диэлектрический гистерезис. Пьезоэффект. Применение диэлектриков в технике.
- •45)Электрический ток. Условия поддержания тока в цепи. Сила тока и плотность тока. Сторонние силы. Эдс источника тока
- •46)Закон Ома для однородного участка цепи. Сопротивление проводника. Зависимость сопротивления от температуры. Явление сверхпроводимости.
- •47)Закон Ома в дифференциальной форме. Закон Ома для неоднородного участка цепи. Закон Ома для полной цепи.
- •48)Разветвленные цепи. Правила Кирхгофа и их применение к расчету цепей.
- •49)Работа и мощность тока. Тепловое действие тока. Закон Джоуля-Ленца.
20) Внутренняя энергия системы. Внутренняя энергия идеального газа и вычисление её через число степеней свободы. Два способа изменения внутренней энергии. Количество теплоты. Теплоемкость. Связь удельной и молярной теплоемкостей.
Внутренняя энергия – функции состояния системы или вещества. Не зависит от того, каким образом система переходит в это состояние, а зависит только от начального и конечного положения.
Внутренняя энергия системы – полная энергия системы, за вычетом Екин системы в целом и за вычетом потенциальной энергии системы в поле внешних сил.
U=Eполн. - Eвнеш.
U=
Идеальный
газ –
газ,
взаимодействием и размерами которого
можно пренебречь. Значит,
 .
Кинетическая
энергия движения молекул определяется
температурой.
.
Кинетическая
энергия движения молекул определяется
температурой.
Особенности:
1)Внутренняя энергия системы является функцией состояния и однозначно определяется параметрами системы;
2)Внутренняя
энергия – величина аддитивная. Для
1 моль вещества: U=(i/2)*K*T*Na
Для
1 моль вещества: U=(i/2)*K*T*Na
K*Na=R, U(1 моль)=(i/2)*R*T
При n моль, dU = (i/2)*n*R*dT
dU - Внутренняя энергия, записанная через число степеней свободы.
Внутреннюю энергию можно изменить двумя способами:
1)совершить над системой работу;
2)сообщить ей некоторое количество теплоты.
КОЛИЧЕСТВО ТЕПЛОТЫ
При теплопередаче (теплообмене) внутренняя энергия одних тел уменьшается, а других – увеличивается, без изменения механической энергии тел и без совершения работы. При этом уменьшается внутренняя энергия тела-нагревателя, а внутренняя энергия нагреваемого тела увеличивается .
 Процесс
теплопередачи характеризуется количеством
теплоты.
Количеством
теплоты (Q)
называется изменение внутренней
энергии тела, происходящее в результате
теплопередачи.
Количество
теплоты измеряется в
системе СИ в джоулях.
[Q]
= 1Дж.
Кроме того, для измерения
количества теплоты (вне системы СИ)
используется единица,
называемая калорией (кал).
1
калория равна количеству теплоты,
необходимому для нагревания 1 г воды на
1 градус С.
Опытным
путем было установлено, что для нагревания
1 г воды на 1 градус требуется
совершить
работу в 4,18 Дж, следовательно 1кал
= 4,18Дж.
Процесс
теплопередачи характеризуется количеством
теплоты.
Количеством
теплоты (Q)
называется изменение внутренней
энергии тела, происходящее в результате
теплопередачи.
Количество
теплоты измеряется в
системе СИ в джоулях.
[Q]
= 1Дж.
Кроме того, для измерения
количества теплоты (вне системы СИ)
используется единица,
называемая калорией (кал).
1
калория равна количеству теплоты,
необходимому для нагревания 1 г воды на
1 градус С.
Опытным
путем было установлено, что для нагревания
1 г воды на 1 градус требуется
совершить
работу в 4,18 Дж, следовательно 1кал
= 4,18Дж.
Теплоёмкость – величина, которая зависит от вида процесса.
Теплоемкость
идеального газа
— это отношение количества теплоты,
сообщенного газу, к изменению температуры
δТ, которое при этом произошло.
![]()


Удельная
теплоёмкость
(Удельная теплота нагревания на один
градус, С уд.) вещества
- количество тепловой энергии, необходимой
для повышения температуры одного
килограмма вещества на один градус.
(Дж/(кг
·К)).
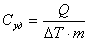 где
где
![]() —
удельная теплоёмкость,
—
удельная теплоёмкость,
![]() —
количество теплоты, полученное веществом
при нагреве (или выделившееся при
охлаждении),
—
количество теплоты, полученное веществом
при нагреве (или выделившееся при
охлаждении),
![]() —
масса нагреваемого (охлаждающегося)
вещества,
—
масса нагреваемого (охлаждающегося)
вещества,
![]() —
разность конечной и начальной температур
вещества.
—
разность конечной и начальной температур
вещества.
Молярная теплоёмкость (Сμ) — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. (Дж/(моль·К)).
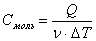 .
.
Удельная
и молярная теплоемкости связаны
соотношением:
![]() ,
где М —
молярная масса (масса одного моля
вещества).
,
где М —
молярная масса (масса одного моля
вещества).
Чаще всего работаем с молярной теплоёмкостью!
21)Работа при изменении объема. Первое начало термодинамики. Формула Майера. Применение первого начала термодинамики к изопроцессам идеального газа.
Работа при изобарном расширении газа. Одним из основных термодинамических процессов, совершающихся в большинстве тепловых машин, является процесс расширения газа с совершением работы. Легко определить работу, совершаемую при изобарном расширении газа.
Если при изобарном расширении газа от объема V1 до объема V2 происходит перемещение поршня в цилиндре на расстояние l (рис. 106), то работа A', совершенная газом, равна
![]() ,
(33.1)
,
(33.1)
где p —
давление газа, ![]() —
изменение его объема.
—
изменение его объема.
Работа при произвольном процессе расширения газа. Произвольный процесс расширения газа от объема V1 до объема V2можно представить как совокупность чередующихся изобарных и изохорных процессов.
При изохорных процессах работа равна нулю, так как поршень в цилиндре не перемещается. Работа при изобарных процессах пропорциональна площади фигуры на диаграмме p, V под соответствующим участком изобары (рис. 108).

Следовательно, работа при произвольном процессе расширения газа прямо пропорциональна площади фигуры под соответствующим участком графика процесса на диаграмме p, V.

Как видно из рисунка 107, при изображении изобарного процесса расширения газа в координатных осях p , V площадь фигуры, ограниченной графиком процесса, кординатами V1 и V2, осью абсцисс, пропорциональна работе газа A'.
Работа при изотермическом расширении газа. Сравнивая площади фигур под участками изотермы и изобары (рис. 109), можно сделать вывод, что расширение газа от объема V1 до объема V2 при одинаковом начальном значении давления газа сопровождается в случае изобарного расширения совершением большей работы.
Работа при сжатии газа. При расширении газа направление вектора силы давления газа совпадает с направлением вектора перемещения, поэтому работа A', совершенная газом, положительна (A' > 0), а работа А внешних сил отрицательна: A = -A' < 0.
При сжатии газа направление вектора внешней силы совпадает с направлением перемещения, поэтому работа А внешних сил положительна (A > 0), а работа A', совершенная газом, отрицательна (A' < 0).
Вывод Формулы Майера
Внутренняя энергия идеального газа является только функцией температуры (и не зависит от V, Р и тому подобных), поэтому формула (4.2.5) справедлива для любого процесса.
Для
произвольной идеальной массы газа:
![]()
(4.2.6) |
При
изобарическом процессе, кроме увеличения
внутренней энергии, происходит совершение
работы газом:
![]()
![]() (4.2.7)
(4.2.7)
Из
основного уравнения молекулярно-кинетической
теории ![]() .
При изобарическом процессе Р = const.
Следовательно, из (4.2.7) получим:
.
При изобарическом процессе Р = const.
Следовательно, из (4.2.7) получим:
![]() (4.2.8)
- Это уравнение
Майера для
одного моля газа.
(4.2.8)
- Это уравнение
Майера для
одного моля газа.
Из этого следует, что физический смысл универсальной газовой постоянной в том, что R – численно равна работе, совершаемой одним молем газа при нагревании на один градус в изобарическом процессе.
Используя это соотношение, Роберт Майер в 1842 г. вычислил механический эквивалент теплоты: 1 кал = 4,19 Дж.
Полезно знать формулу Майера для удельных теплоёмкостей:
|
|
|
|
или
|
|
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными.
