
- •Основные понятия.
- •Основные понятия.
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •§ 1.2. Способы задания движения точки
- •2. Криволинейное движение
- •6. Поступательное и вращательное движения абсолютно твердого тела
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •Вид преобразований при коллинеарных осях[4]
- •Теорема об изменении кинетической энергии материальной точки.
- •14. Механическая система. Силы внешние и внутренние.
- •Теорема об изменении кинетической энергии системы материальных точек.
- •Сила вязкого трения
- •16. Сила упругости
- •Виды деформации твердых тел Деформация растяжения
- •Деформация сжатия
- •Деформация сдвига
- •Деформация изгиба
- •Деформация кручения
- •Пластическая и упругая деформация
- •18. Работа и потенциальная энергия
- •Абсолютно неупругий удар
- •Динамика абсолютно твердого тела
- •§1 Момент инерции. Теорема Штейнера
- •27. Движение тела переменной массы
- •Механические колебания и волны
- •30. Графический метод сложения колебаний. Векторная диаграмма. Методом вращающегося вектора амплитуды.
- •Различные формы траектории суммы колебаний. Фигуры Лиссажу.
- •31. Сложение взаимно перпендикулярных колебаний.
- •Характеристики затухающих колебаний
- •33. Вынужденные механические колебания
- •Механическая волна
- •Основные характеристики волны
- •Уравнение бегущей волны
- •Продольная и поперечная волны
- •36. Энергетические характеристики волн
- •Энергия волны
- •Уравнение стоячей волны
- •Сущность явления
- •[Править]Математическое описание
- •[Править]Релятивистский эффект Доплера
- •Движение с постоянной скоростью
- •Строгое определение
- •[Править]Объяснение
- •Преобразования Лоренца в математике
- •[Править]Определение
- •[Править]Общие свойства
- •41. Относительность одновременности
- •[Править]Сокращение линейных размеров
- •[Править]Эффект Доплера
- •[Править]Аберрация
- •42. Релятивистская динамика [править]Энергия и импульс
- •[Править]Уравнения движения
- •[Править]Преобразования энергии и импульса
- •44. Дифференциальная форма
- •Уравнение неразрывности
- •45. Закон Бернулли
- •46. Вязкость. Ламинарные и турбулентные режимы течения
- •49. Основное уравнение мкт газа
- •[Править]Идеальные газы
- •Г.А.Белуха, школа № 4, г. Ливны, Орловская обл. Работа газа в термодинамике Методические рекомендации по изучению темы, 10-й класс
- •[Править]Определение
- •51. 3. Первое начало термодинамики
- •4.4 Теплоемкость
- •Физический смысл адиабатического процесса
- •[Править]Работа газа
- •Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
- •[Править]Вывод уравнения
- •[Править]Показатель адиабаты
- •Политропный процесс
- •[Править]Показатель политропы
- •55. 3.9. Закон возрастания энтропии
- •Кпд тепловой машины Карно
- •Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Уравнение Гиббса
- •Условия фазового равновесия
- •[Править]Элементарный вывод
- •58. Капиллярные явления
[Править]Показатель политропы
Кривая на термодинамических диаграммах, изображающая политропный процесс, называется «политропа». Для идеального газа уравнение политропы может быть записано в виде:
![]()
где р — давление, V — объем газа, n — «показатель политропы».
![]() .
Здесь
—
теплоёмкость газа в данном процессе,
.
Здесь
—
теплоёмкость газа в данном процессе, ![]() и
и ![]() —
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
—
теплоемкости того же газа, соответственно,
при постоянном давлении и объеме.
В зависимости от вида процесса, можно определить значение n:
Изотермический процесс:
 ,
так как
,
так как 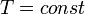 ,
значит, по закону
Бойля — Мариотта
,
значит, по закону
Бойля — Мариотта  ,
и уравнение политропы вынуждено
выглядеть так:
,
и уравнение политропы вынуждено
выглядеть так: 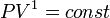 .
.
Изобарный процесс:
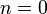 ,
так как
,
так как 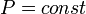 ,
и уравнение политропы вынуждено
выглядеть так:
,
и уравнение политропы вынуждено
выглядеть так: 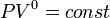 .
.
Адиабатный процесс:
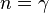 (здесь
(здесь 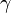 — показатель
адиабаты),
это следует из уравнения
Пуассона.
— показатель
адиабаты),
это следует из уравнения
Пуассона.
Изохорный процесс:
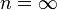 ,
так как
,
так как 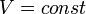 ,
и в процессе
,
и в процессе 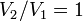 ,
а из уравнения политропы следует, что
,
а из уравнения политропы следует, что 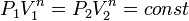 ,
то есть, что
,
то есть, что 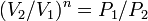 ,
то есть
,
то есть  ,
а это возможно, только если
,
а это возможно, только если 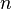 является
бесконечным.
является
бесконечным.
54.
Круговые обратимые и необратимые процессы |
|
|
|
|
|
||||||||||||||||||||||
Прежде чем переходить к изложению второго закона термодинамики, рассмотрим круговые процессы. Круговым процессом, или циклом, называется такой процесс, в результате которого термодинамическое тело возвращается в исходное состояние. В диаграммах состояния P, V и других круговые процессы изображается в виде замкнутых кривых (рис. 5.1). Это связано с тем, что в любой диаграмме два тождественных состояния (начало и конец кругового процесса) изображаются одной и той же точкой на плоскости.
Цикл,
совершаемый идеальным газом, можно
разбить на процессы расширения (1
– 2) и сжатия (2 – 1) газа.
Работа расширения (определяется
площадью фигуры 1a2V2V11)
положительна (
(цикл протекает по часовой стрелке), то он называется прямым (рис. 5.1). Если за цикл совершается отрицательная работа
(цикл протекает против часовой стрелки), то он называется обратным (рис. 5.2). Круговые процессы лежат в основе всех тепловых машин: двигателей внутреннего сгорания, паровых и газовых турбин, паровых и холодильных машин и т. д. В результате кругового процесса система возвращается в исходное состояние, и следовательно полное изменение внутренней энергии газа равно нулю. Поэтому первое начало термодинамики для кругового процесса
т.е. работа, совершаемая за цикл, равна количеству полученной извне теплоты. Однако в результате кругового процесса система может теплоту как получать, так и отдавать, поэтому
где Q1 – количество теплоты, полученное системой; Q2 – количество теплоты, отданное системой. Поэтому термический коэффициент полезного действия для кругового процесса
Все термодинамические процессы, в том числе и круговые, делят на две группы: обратимые и необратимые. Процесс называют обратимым, если он протекает таким образом, что после окончания процесса он может быть проведен в обратном направлении через все те же промежуточные состояния, что и прямой процесс. После проведения кругового обратимого процесса никаких изменений в среде, окружающей систему, не произойдет. При этом под средой понимается совокупность всех не входящих в систему тел, с которыми система непосредственно взаимодействует. Процесс называется необратимым, если он протекает так, что после его окончания систему нельзя вернуть в начальное состояние через прежние промежуточные состояния.Нельзя осуществить необратимый круговой процесс, чтобы нигде в окружающей среде не осталось никаких изменений. Свойством обратимости обладают только равновесные процессы. Каждое промежуточное состояние является состоянием термодинамического равновесия, нечувствительного к тому, идет ли процесс в прямом или обратном направлении. Например, обратимым можно считать процесс адиабатического расширения или сжатия газа. При адиабатическом процессе условие теплоизолированности системы исключает непосредственный теплообмен между системой и средой. Поэтому, производя адиабатическое расширение газа, а затем сжатие, можно вернуть газ в исходное состояние так, что в окружающей среде никаких изменений не произойдет. Конечно, в реальных условиях, и в этом случае, всегда имеется некоторая необратимость процесса, обусловленная, например, несовершенством теплоизоляции, трением при движении поршня и т.д. Только в обратимых процессах теплота используется по назначению, не расходуется зря. Если процесс неравновесный, то будет необратимый переход, т.е. часть энергии уйдет (необратимо). Максимальным КПД обладают машины, у которых только обратимые процессы. Реальные процессы сопровождаются диссипацией энергии (из-за трения, теплопроводности и т.д.), которая нами не рассматривается. Обратимые процессы – это в какой-то степени идеализация реальных процессов. Их рассмотрение важно по двум причинам:
Доступны следующие дополнительные демонстрации: 1. Гидравлическая машина. 2. Гидростатическое давление. |
|||||||||||||||||||||||
Второе
начало термодинамики. Запрещая
вечный двигатель 1-го рода, первое
начало Термодинамика не
исключает возможности создания такой
машины непрерывного действия, которая
была бы способна превращать в полезную
работу практически всю подводимую к
ней теплоту (так называемый вечный
двигатель 2-го рода). Однако весь опыт
по конструированию тепловых машин,
имевшийся в начале 19 в., указывал на то,
что кпд этих машин (отношение затраченной
теплоты к полученной работе) всегда
существенно меньше единицы: часть
теплоты неизбежно рассеивается в
окружающую среду. С. Карно первым
показал (1824), что это обстоятельство
имеет принципиальный характер, то есть
любая тепловая машина должна содержать
помимо нагревателя (источника теплоты)
и рабочего тела, совершающего
термодинамический цикл (например, пара),
также и холодильник, имеющий температуру,
обязательно более низкую, чем температура
нагревателя. Второе
начало термодинамики представляет
собой обобщение вывода Карно на
произвольные термодинамические процессы,
протекающие в природе. Р. Клаузиус (1850)
дал 2-му началу следующую формулировку:
теплота не может самопроизвольно перейти
от системы с меньшей температурой к
системе с большей температурой. Независимо
в несколько иной форме этот принцип
высказал У. Томсон (Кельвин)
в 1851: невозможно построить периодически
действующую машину, вся деятельность
которой сводилась бы к поднятию некоторого
груза (совершению механической работы)
и соответствующему охлаждению теплового
резервуара. Несмотря на качественный
характер этого утверждения, оно приводит
к далеко идущим количественным
следствиям.
Прежде всего оно позволяет определить
максимальный кпд тепловой машины. Если
машина работает на основе Карно
цикла, то
на протяжении изотермического контакта
с нагревателем (Т
= T1)
рабочее тело получает количество теплоты
DQ1,
а на другом изотермическом участке
цикла, находясь в контакте с холодильником
(Т
= Т2), отдаёт
ему количество теплоты D Q2.
Отношение DQ2/DQ1 должно
быть одним и тем же у всех машин с
обратимым циклом Карно, у которых
одинаковы соответственно температуры
нагревателей и холодильников, и не может
зависеть от природы рабочего тела. Если
бы это было не так, то машину с большей
величиной указанного отношения можно
было бы заставить работать в обратном
направлении (поскольку циклы обратимы),
приводя её в действие с помощью машины
с меньшей величиной отношения. Эта
комбинированная машина обладала бы тем
свойством, что в ней теплота от холодильника
передавалась бы нагревателю без
совершения работы. Согласно 2-му
началу Термодинамика это
невозможно, и поэтому отношение DQ2 /DQ1 у
обеих машин должно быть одинаковым. В
частности, оно должно быть тем же, что
и в случае, когда рабочим телом является
идеальный газ. Здесь это отношение легко
может быть найдено, и, таким образом,
оказывается, что для всех обратимых
циклов Карно
![]() .
(3)
Это
выражение называется пропорцией Карно.
В результате для всех машин с обратимым
циклом Карно кпд максимален и равен h=
(T1 —
T2)/T1. В
случае, если цикл необратим, то кпд
оказывается меньше этой величины.
Необходимо подчеркнуть, что пропорция
Карно и кпд цикла Карно имеют указанный
вид только в том случае, если температура
измерена в абсолютной температурной
шкале. Пропорция Карно положена в основу
определения абсолютной температурной
шкалы (см. Температурные
шкалы). Следствием
2-го начала Термодинамика (пропорции
Карно) является существование энтропии как
функции состояний. Если ввести
величину S, изменение
которой при изотермическом обратимом
сообщении системе количества теплоты
DQ есть
DS =
DQ/T,
то полное приращение S в
цикле Карно будет равно нулю; на
адиабатических участках цикла DS =
0 (так как DQ =
0), а изменения на изотермических участках
компенсируют друг друга. Полное
приращение S оказывается
равным нулю и при осуществлении
произвольного обратимого цикла, что
доказывается разбиением цикла на
последовательность бесконечно тонких
циклов Карно (с малыми изотермическими
участками). Отсюда следует (как и в случае
внутренней энергии), что энтропия Sявляется
функцией состояния системы, то есть
изменение энтропии не зависит от пути
перехода. Используя понятие энтропии,
Клаузиус (1876) показал, что исходная
формулировка 2-го начала Термодинамика полностью
эквивалентна следующей: существует
функция состояния системы, её энтропия S,
приращение которой при обратимом
сообщении системе теплоты равно
dS
= dQ/T; (4)
при
реальных (необратимых) адиабатических
процессах энтропия возрастает, достигая
максимальное значения в состоянии
равновесия.
Термодинамические
потенциалы. Определение
энтропии позволяет написать следующие
выражения для дифференциалов внутренней
энергии и энтальпии:
dU
= TdS – pdV, dH = TdS + Vdp. (5)
Отсюда
видно, что естественными независимыми
параметрами состояния для
функций U и Н являются
соответственно пары S,
V и
S, р. Если
же вместо энтропии в качестве независимого
параметра используется температура,
то для описания системы более удобны
свободная энергия (Гельмгольцева
энергия, или
изохорно-изотермический
потенциал) F= U — TS (для
переменных Т и V)
и термодинамический потенциал G
= Н — TS для
переменных Т и р (Гиббсова
энергия,или
изобарно-изотермический потенциал),
дифференциалы которых равны
dF
= – SdT – pdV, dG = –SdT + Vdp. (6)
Функции
состояний U,
Н, F и G называются потенциалами
термодинамическими системы
для соответствующих пар независимых
переменных. Метод термодинамических
потенциалов (Дж. Гиббс, 1874—1878), основанный
на совместном применении 1-го и 2-го
начал Термодинамика,
позволяет получить ряд важных
термодинамических соотношений между
различными физическими свойствами
системы. Так, использование независимости
вторых смешанных производных от порядка
дифференцирования приводит к связи
между теплоёмкостями ср и cv, коэффициентом
теплового расширения
.
(3)
Это
выражение называется пропорцией Карно.
В результате для всех машин с обратимым
циклом Карно кпд максимален и равен h=
(T1 —
T2)/T1. В
случае, если цикл необратим, то кпд
оказывается меньше этой величины.
Необходимо подчеркнуть, что пропорция
Карно и кпд цикла Карно имеют указанный
вид только в том случае, если температура
измерена в абсолютной температурной
шкале. Пропорция Карно положена в основу
определения абсолютной температурной
шкалы (см. Температурные
шкалы). Следствием
2-го начала Термодинамика (пропорции
Карно) является существование энтропии как
функции состояний. Если ввести
величину S, изменение
которой при изотермическом обратимом
сообщении системе количества теплоты
DQ есть
DS =
DQ/T,
то полное приращение S в
цикле Карно будет равно нулю; на
адиабатических участках цикла DS =
0 (так как DQ =
0), а изменения на изотермических участках
компенсируют друг друга. Полное
приращение S оказывается
равным нулю и при осуществлении
произвольного обратимого цикла, что
доказывается разбиением цикла на
последовательность бесконечно тонких
циклов Карно (с малыми изотермическими
участками). Отсюда следует (как и в случае
внутренней энергии), что энтропия Sявляется
функцией состояния системы, то есть
изменение энтропии не зависит от пути
перехода. Используя понятие энтропии,
Клаузиус (1876) показал, что исходная
формулировка 2-го начала Термодинамика полностью
эквивалентна следующей: существует
функция состояния системы, её энтропия S,
приращение которой при обратимом
сообщении системе теплоты равно
dS
= dQ/T; (4)
при
реальных (необратимых) адиабатических
процессах энтропия возрастает, достигая
максимальное значения в состоянии
равновесия.
Термодинамические
потенциалы. Определение
энтропии позволяет написать следующие
выражения для дифференциалов внутренней
энергии и энтальпии:
dU
= TdS – pdV, dH = TdS + Vdp. (5)
Отсюда
видно, что естественными независимыми
параметрами состояния для
функций U и Н являются
соответственно пары S,
V и
S, р. Если
же вместо энтропии в качестве независимого
параметра используется температура,
то для описания системы более удобны
свободная энергия (Гельмгольцева
энергия, или
изохорно-изотермический
потенциал) F= U — TS (для
переменных Т и V)
и термодинамический потенциал G
= Н — TS для
переменных Т и р (Гиббсова
энергия,или
изобарно-изотермический потенциал),
дифференциалы которых равны
dF
= – SdT – pdV, dG = –SdT + Vdp. (6)
Функции
состояний U,
Н, F и G называются потенциалами
термодинамическими системы
для соответствующих пар независимых
переменных. Метод термодинамических
потенциалов (Дж. Гиббс, 1874—1878), основанный
на совместном применении 1-го и 2-го
начал Термодинамика,
позволяет получить ряд важных
термодинамических соотношений между
различными физическими свойствами
системы. Так, использование независимости
вторых смешанных производных от порядка
дифференцирования приводит к связи
между теплоёмкостями ср и cv, коэффициентом
теплового расширения ![]() и
изотермическим коэффициентом
сжатия
и
изотермическим коэффициентом
сжатия ![]()
![]() к
соотношению между изотермическим и
адиабатическим коэффициентами
сжатия
к
соотношению между изотермическим и
адиабатическим коэффициентами
сжатия ![]() и т.
п. Из условия, что изолированная система
в равновесном состоянии обладает
максимальным значением энтропии,
вытекает условие минимальности
термодинамических потенциалов в
равновесном состоянии по отношению к
произвольным малым отклонениям от
равновесия при фиксированных значениях
соответствующих независимых переменных.
Это приводит к важным неравенствам
(условиям устойчивости), в частности
и т.
п. Из условия, что изолированная система
в равновесном состоянии обладает
максимальным значением энтропии,
вытекает условие минимальности
термодинамических потенциалов в
равновесном состоянии по отношению к
произвольным малым отклонениям от
равновесия при фиксированных значениях
соответствующих независимых переменных.
Это приводит к важным неравенствам
(условиям устойчивости), в частности
![]() ,
cp > cv >
0 (см. Устойчивость
термодинамическая).
,
cp > cv >
0 (см. Устойчивость
термодинамическая).
