
- •Основные понятия.
- •Основные понятия.
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •§ 1.2. Способы задания движения точки
- •2. Криволинейное движение
- •6. Поступательное и вращательное движения абсолютно твердого тела
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •Вид преобразований при коллинеарных осях[4]
- •Теорема об изменении кинетической энергии материальной точки.
- •14. Механическая система. Силы внешние и внутренние.
- •Теорема об изменении кинетической энергии системы материальных точек.
- •Сила вязкого трения
- •16. Сила упругости
- •Виды деформации твердых тел Деформация растяжения
- •Деформация сжатия
- •Деформация сдвига
- •Деформация изгиба
- •Деформация кручения
- •Пластическая и упругая деформация
- •18. Работа и потенциальная энергия
- •Абсолютно неупругий удар
- •Динамика абсолютно твердого тела
- •§1 Момент инерции. Теорема Штейнера
- •27. Движение тела переменной массы
- •Механические колебания и волны
- •30. Графический метод сложения колебаний. Векторная диаграмма. Методом вращающегося вектора амплитуды.
- •Различные формы траектории суммы колебаний. Фигуры Лиссажу.
- •31. Сложение взаимно перпендикулярных колебаний.
- •Характеристики затухающих колебаний
- •33. Вынужденные механические колебания
- •Механическая волна
- •Основные характеристики волны
- •Уравнение бегущей волны
- •Продольная и поперечная волны
- •36. Энергетические характеристики волн
- •Энергия волны
- •Уравнение стоячей волны
- •Сущность явления
- •[Править]Математическое описание
- •[Править]Релятивистский эффект Доплера
- •Движение с постоянной скоростью
- •Строгое определение
- •[Править]Объяснение
- •Преобразования Лоренца в математике
- •[Править]Определение
- •[Править]Общие свойства
- •41. Относительность одновременности
- •[Править]Сокращение линейных размеров
- •[Править]Эффект Доплера
- •[Править]Аберрация
- •42. Релятивистская динамика [править]Энергия и импульс
- •[Править]Уравнения движения
- •[Править]Преобразования энергии и импульса
- •44. Дифференциальная форма
- •Уравнение неразрывности
- •45. Закон Бернулли
- •46. Вязкость. Ламинарные и турбулентные режимы течения
- •49. Основное уравнение мкт газа
- •[Править]Идеальные газы
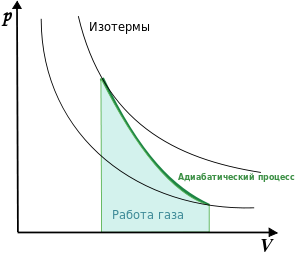
- •Г.А.Белуха, школа № 4, г. Ливны, Орловская обл. Работа газа в термодинамике Методические рекомендации по изучению темы, 10-й класс
- •[Править]Определение
- •51. 3. Первое начало термодинамики
- •4.4 Теплоемкость
- •Физический смысл адиабатического процесса
- •[Править]Работа газа
- •Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
- •[Править]Вывод уравнения
- •[Править]Показатель адиабаты
- •Политропный процесс
- •[Править]Показатель политропы
- •55. 3.9. Закон возрастания энтропии
- •Кпд тепловой машины Карно
- •Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Уравнение Гиббса
- •Условия фазового равновесия
- •[Править]Элементарный вывод
- •58. Капиллярные явления
Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[6][15][16]
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
График
адиабаты (жирная линия) на ![]() диаграмме
для газа.
—
давление газа;
диаграмме
для газа.
—
давление газа;
![]() —
объём.
—
объём.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где ![]() — абсолютная
температура газа.
Или к виду
— абсолютная
температура газа.
Или к виду
![]()
Поскольку ![]() всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
всегда
больше 1, из последнего уравнения следует,
что при адиабатическом сжатии (то есть
при уменьшении
)
газ нагревается (
возрастает),
а при расширении — охлаждается, что
всегда верно и для реальных газов.
Нагревание при сжатии больше для того
газа, у которого больше коэффициент
.
[Править]Вывод уравнения
Согласно закону Менделеева — Клапейрона[6] справедливо соотношение
![]()
где R — универсальная газовая постоянная. Продифференцировав обе части, получаем
-
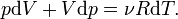
(3)
Если
в (3) подставить ![]() из (2),
а затем
из (2),
а затем ![]() из (1),
получим
из (1),
получим
![]()
или, введя коэффициент :
![]() .
.
Это уравнение можно переписать в виде
![]()
что после интегрирования даёт уравнение
![]() .
.
Окончательно получаем
![]()
что и требовалось доказать.
[Править]Показатель адиабаты
Основная статья: Показатель адиабаты
При
адиабатическом процессе показатель
адиабаты равен ![]() .
.
Для
нерелятивистского невырожденного
одноатомного идеального газа ![]() [19],
для двухатомного
[19],
для двухатомного ![]() [19],
для трёхатомного
[19],
для трёхатомного ![]() ,
для газов, состоящих из более сложных
молекул, показатель адиабаты
определяется
числом степеней
свободы (i)
конкретной молекулы, исходя из
соотношения
,
для газов, состоящих из более сложных
молекул, показатель адиабаты
определяется
числом степеней
свободы (i)
конкретной молекулы, исходя из
соотношения ![]() .
.
Для реальных газов показатель адиабаты отличается от показателя адиабаты для идеальных газов, особенно для низких температур, когда большую роль начинает играть межмолекулярное взаимодействие. Для его теоретического нахождения следует проводить расчёт без некоторых допущений, в частности, использованных при выводе формулы (1) и использовать формулу (1а).
Один
из методов для экспериментального
определения показателя был предложен
в 1819 г. Клеманом и Дезормом. Стеклянный
баллон вместимостью несколько литров
наполняется исследуемым газом при
давлении ![]() .
Затем открывается кран, газ адиабатически
расширяется, и давление падает до
атмосферного —
.
Затем открывается кран, газ адиабатически
расширяется, и давление падает до
атмосферного — ![]() .
Затем происходит его изохорноенагревание
до температуры окружающей среды. Давление
повышается до
.
Затем происходит его изохорноенагревание
до температуры окружающей среды. Давление
повышается до ![]() .
В результате такого эксперимента k можно
вычислить как[20]
.
В результате такого эксперимента k можно
вычислить как[20]
![]()
Политропный процесс
[править]
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 февраля 2012; проверки требуют 11 правок.
Политропный процесс, политропический процесс — термодинамический процесс, во время которого удельная теплоёмкость газа остаётся неизменной.
В
соответствии с сущностью понятия
теплоёмкости ![]() ,
предельными частными явлениями
политропного процесса являются изотермический
процесс (
,
предельными частными явлениями
политропного процесса являются изотермический
процесс (![]() )
и адиабатный
процесс (
)
и адиабатный
процесс (![]() ).
).
В случае идеального газа, изобарный процесс и изохорный процесс также являются политропными ?.
