
- •Основные понятия.
- •Основные понятия.
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •§ 1.2. Способы задания движения точки
- •2. Криволинейное движение
- •6. Поступательное и вращательное движения абсолютно твердого тела
- •Первый закон Ньютона (закон инерции Галилея -Ньютона).
- •Второй закон Ньютона.
- •Третий закон Ньютона.
- •Вид преобразований при коллинеарных осях[4]
- •Теорема об изменении кинетической энергии материальной точки.
- •14. Механическая система. Силы внешние и внутренние.
- •Теорема об изменении кинетической энергии системы материальных точек.
- •Сила вязкого трения
- •16. Сила упругости
- •Виды деформации твердых тел Деформация растяжения
- •Деформация сжатия
- •Деформация сдвига
- •Деформация изгиба
- •Деформация кручения
- •Пластическая и упругая деформация
- •18. Работа и потенциальная энергия
- •Абсолютно неупругий удар
- •Динамика абсолютно твердого тела
- •§1 Момент инерции. Теорема Штейнера
- •27. Движение тела переменной массы
- •Механические колебания и волны
- •30. Графический метод сложения колебаний. Векторная диаграмма. Методом вращающегося вектора амплитуды.
- •Различные формы траектории суммы колебаний. Фигуры Лиссажу.
- •31. Сложение взаимно перпендикулярных колебаний.
- •Характеристики затухающих колебаний
- •33. Вынужденные механические колебания
- •Механическая волна
- •Основные характеристики волны
- •Уравнение бегущей волны
- •Продольная и поперечная волны
- •36. Энергетические характеристики волн
- •Энергия волны
- •Уравнение стоячей волны
- •Сущность явления
- •[Править]Математическое описание
- •[Править]Релятивистский эффект Доплера
- •Движение с постоянной скоростью
- •Строгое определение
- •[Править]Объяснение
- •Преобразования Лоренца в математике
- •[Править]Определение
- •[Править]Общие свойства
- •41. Относительность одновременности
- •[Править]Сокращение линейных размеров
- •[Править]Эффект Доплера
- •[Править]Аберрация
- •42. Релятивистская динамика [править]Энергия и импульс
- •[Править]Уравнения движения
- •[Править]Преобразования энергии и импульса
- •44. Дифференциальная форма
- •Уравнение неразрывности
- •45. Закон Бернулли
- •46. Вязкость. Ламинарные и турбулентные режимы течения
- •49. Основное уравнение мкт газа
- •[Править]Идеальные газы
- •Г.А.Белуха, школа № 4, г. Ливны, Орловская обл. Работа газа в термодинамике Методические рекомендации по изучению темы, 10-й класс
- •[Править]Определение
- •51. 3. Первое начало термодинамики
- •4.4 Теплоемкость
- •Физический смысл адиабатического процесса
- •[Править]Работа газа
- •Уравнение Пуассона для идеального газа [править]Адиабата Пуассона
- •[Править]Вывод уравнения
- •[Править]Показатель адиабаты
- •Политропный процесс
- •[Править]Показатель политропы
- •55. 3.9. Закон возрастания энтропии
- •Кпд тепловой машины Карно
- •Пра́вило фаз (или правило фаз Гиббса) — соотношение, связывающее число веществ (компонентов), фаз и степеней свободы в гетерогенной системе. Уравнение Гиббса
- •Условия фазового равновесия
- •[Править]Элементарный вывод
- •58. Капиллярные явления
51. 3. Первое начало термодинамики
Первое начало термодинамики обычно формулируется в виде утверждения:
При переходе из состояния 1 в состояние 2 поглощенное телом тепло расходуется на совершение механической работы и увеличение внутренней энергии системы:
|
(3) |
(![]() -
изменение внутренней энергии системы).
-
изменение внутренней энергии системы).
Все
входящие в данное соотношение величины
могут принимать положительные и
отрицательные значения: тепло ![]() положительно,
если оно поглощается системой, и
отрицательно, если оно отдается;
работа
положительно,
если оно поглощается системой, и
отрицательно, если оно отдается;
работа ![]() положительна,
если она совершается системой над
внешними телами, и отрицательна, если
работа совершается над системой;
изменение внутренней энергии положительно,
если поглощенное тепло больше, чем
совершенная работа, если же тепла
поглощается меньше, чем производится
работы (например, при адиабатическом
расширении), то внутренняя энергия
системы уменьшается:
положительна,
если она совершается системой над
внешними телами, и отрицательна, если
работа совершается над системой;
изменение внутренней энергии положительно,
если поглощенное тепло больше, чем
совершенная работа, если же тепла
поглощается меньше, чем производится
работы (например, при адиабатическом
расширении), то внутренняя энергия
системы уменьшается: ![]() .
.
Проанализируем смысл сделанного утверждения.
Во-первых, оно означает введение новой величины - внутренней энергии системы, которая может увеличиваться или уменьшаться в зависимости от соотношения поглощенного тепла и произведенной работы.
Во-вторых, в нем содержится так называемый принцип эквивалентности тепла и механической работы. Этот принцип заключается в том, что тепло и работа являются различными формами энергообмена системы с окружающей средой. Одно и то же изменение внутренней энергии системы может быть достигнуто за счет совершения работы без поглощения или выделения тепла (в адиабатическом процессе) либо за счет теплообмена без совершения работы (в изохорном процессе). В результате поглощения тепла система может совершать полезную работу, и наоборот - внешняя работа при определенных условиях может приводить к выделению системой тепла. Эквивалентность тепла и работы с сегодняшних позиций представляется очевидной. Действительно, нагревание тел в результате трения было известно с первобытных времен. Однако ясное научное понимание взаимосвязи тепловых и механических явлений было достигнуто лишь к середине прошлого столетия.
В-третьих, первое начало термодинамики представляет собой обобщенный закон сохранения энергии, который утверждает, что во всех процессах перехода энергии из тепловой формы в механическую и наоборот разница между поглощенным теплом и произведенной работой в точности покрывается изменением внутренней энергии системы.
Первое начало термодинамики впервые было сформулировано в работе Р. Майера (1841 г.), которая, однако, стала известной лишь после появления работ Джоуля, Клаузиуса и Гельмгольца. Наиболее значительный вклад в экспериментальную проверку первого начала внес Д. Джоуль, который с поразительной для того времени точностью определил механический эквивалент тепла, то есть установил соотношение между единицами измерения тепла и работы. Используемая в настоящее время так называемая международная калория содержит 4,1868 Дж.
Приведенная выше формулировка первого начала термодинамики не является полной. Для того, чтобы сделать к ней необходимое дополнение, рассмотрим следующую задачу.
Идеальный
газ переходит из состояния 1 в
состояние 2 (давление ![]() ,
объем
,
объем ![]() )
двумя способами: в первом способе вначале
происходит расширение газа при постоянном
давлении, а затем - уменьшение давления
при постоянном объеме; во втором способе,
наоборот, сначала уменьшается давление
при постоянном объеме, а затем происходит
изобарное расширение (рис. 3).
Найти поглощенное тепло, совершенную
работу и изменение внутренней энергии
в каждом из способов.
)
двумя способами: в первом способе вначале
происходит расширение газа при постоянном
давлении, а затем - уменьшение давления
при постоянном объеме; во втором способе,
наоборот, сначала уменьшается давление
при постоянном объеме, а затем происходит
изобарное расширение (рис. 3).
Найти поглощенное тепло, совершенную
работу и изменение внутренней энергии
в каждом из способов.
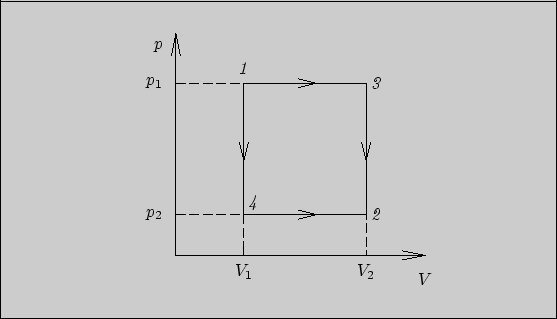
Рис. 3
Решение. Из рисунка видно, что впервом способе переход системы из состояния 1 в состояние 2 осуществляется через промежуточное состояние 3, во втором способе - через состояние 4. Работа в первом способе равна
![]()
во втором способе -
![]()
При вычислении поглощенного тепла будем для простоты считать, что количество газа - один моль. Тогда в первом способе поглощенное тепло составляет
![]()
во втором способе -
![]()
Для
молярных теплоемкостей ![]() и
и ![]() идеального
газа существует известное соотношение
Майера:
идеального
газа существует известное соотношение
Майера:
![]()
где ![]() -
универсальная газовая постоянная.
Пользуясь этим соотношением и уравнением
состояния идеального газа
-
универсальная газовая постоянная.
Пользуясь этим соотношением и уравнением
состояния идеального газа
![]()
выразим ![]() и
и ![]() через
данные в задаче значения давлений и
объемов:
через
данные в задаче значения давлений и
объемов:
![]()
![]()
Для изменения внутренней энергии, используя уравнение первого начала термодинамики (3), в том и другом случае получаем
![]()
Из рассмотренной задачи можно сделать два вывода.
Поглощенное тепло и совершенная работа зависят не только от начального и конечного состояний системы, но и от способа перехода (такие величины называются функциями процесса; к функциям процесса из известных нам величин относится также теплоемкость).
Изменение внутренней энергии в данном случае, то есть для идеального газа и данного набора процессов, оказалось зависящим только от параметров начального и конечного состояний (
 )
и не зависящим от способа перехода.
)
и не зависящим от способа перехода.
В молекулярной физике второй вывод легко обобщить на любые системы и любые процессы. Действительно, если представлять внутреннюю энергию как среднее значение полной механической энергии всех частиц системы, то ясно, что это значение не должно зависеть от способа перехода системы в данное термодинамическое состояние.
В аксиоматической термодинамике обобщение второго вывода из нашей задачи на случай произвольной системы и произвольных процессов имеет характер постулата, который и является необходимым дополнением формулировки первого начала термодинамики, данной в начале параграфа. С учетом этого первое начало можно сформулировать следующим образом.
Термодинамическому состоянию системы соответствует определенное значение ее внутренней энергии, которое может увеличиваться при поглощении системой тепла либо при совершении над ней работы:
![]()
Обратим
внимание, что данная формулировка
определяет не само значение внутренней
энергии, а ее изменение при переходе из
состояния 1 в
состояние 2.
Таким образом, сама внутренняя энергия
системы ![]() определяется
с точностью до произвольного постоянного
слагаемого.
определяется
с точностью до произвольного постоянного
слагаемого.
Величины, значение которых определяется термодинамическим состоянием системы и не зависит от способа перехода системы в это состояние, называются функциями или параметрами состояния. К параметрам состояния относятся температура, давление, объем, масса, плотность системы.
Выше говорилось, что тепло, поглощенное однородной системой, делится между ее частями в отношении их масс (в состоянии равновесия). Иными словами, поглощенное системой тепло складывается из порций тепла, поглощенного частями системы (при такой формулировке однородности системы и равновесия между ее частями не требуется). Аналогичным свойством обладает работа системы. Это можно пояснить следующим образом. Мысленно разобьем столб газа под поршнем (см. рис. 1) вертикальной стенкой на две части. К каждой из этих частей будет относиться все сказанное о целом столбе. Тогда
![]()
то
есть работа в результате сдвига поршня
на ![]() складывается
из работ двух частей столба газа. То же
справедливо при разбиении на произвольное
количество частей.
складывается
из работ двух частей столба газа. То же
справедливо при разбиении на произвольное
количество частей.
Из этих рассуждений с учетом первого начала термодинамики вытекает свойство аддитивности внутренней энергии системы: внутренняя энергия системы складывается из внутренних энергий ее частей (подсистем).
Свойство аддитивности внутренней энергии позволяет обобщить первое начало термодинамики на задачи, в которых учитывается обмен веществом между системами. Для этого нужно порции вещества, участвующие в обмене, представлять как отдельные части системы и применять к ним первое начало термодинамики как к системам.
И конспект
52. Теплоёмкость тела (обычно обозначается латинской буквой C) — физическая величина, определяющая отношение бесконечно малого количества теплоты δQ, полученного телом, к соответствующему приращению его температуры δT:
![]()
Единица измерения теплоёмкости в системе СИ — Дж/К.
ТЕПЛОЕМКОСТЬ, кол-во теплоты, затрачиваемое для изменения т-ры на 1 °С. Согласно более строгому определению, теплоемкость-термодинамич. величина, определяемая выражением:
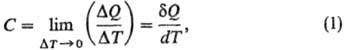
где Q- кол-во теплоты, сообщенное системе и вызвавшее изменение ее т-ры на Т. Отношение конечных разностей Q/Т наз. средней теплоемкостью, отношение бесконечно малых величин Q/dT-истинной теплоемкостью. Поскольку Q не является полным дифференциалом ф-ции состояния, то и теплоемкость зависит от пути перехода между двумя состояниями системы. Различают теплоемкость системы в целом (Дж/К), удельную теплоемкость [Дж/(г·К)], молярную теплоемкость [Дж/(моль·К)]. Во всех ниже приведенных ф-лах использованы молярные величины теплоемкости.
Из второго начала термодинамики следует, что теплоемкость пропорциональна производной от энтропии системы S по т-ре Т при постоянстве внеш. силы или термодинамич. координаты (обозначается индексом z):
![]()
Наиб. важными видами теплоемкости являются теплоемкость CV при постоянном объеме V и теплоемкость Ср при постоянном давлении р:
СV = (9U/9T)V = T(9S/9T)V, Ср = (9Н/9Т)р = Т(9S/9Т)р,
где U-внутр. энергия, H-энтальпия системы. Значения Ср и СV связаны соотношением:
![]()
где = V-1(9V/9Т)р-коэф. термич. расширения, x = = — V-1(9V/9р)T-коэф. изотермич. сжимаемости. Поскольку по условиям устойчивости фаз Ср, CV > 0 и (9V/9р)T < 0, то согласно (3) Ср > CV. Это естественно, т. к. при изобарич. нагревании часть тепла, помимо увеличения внутр. энергии системы, идет на работу расширения. Для идеальных газов (9U/9V)T = 0 и учет ур-ния состояния pV= RT приводит к соотношению: Сp - CV = R (R-газовая постоянная). Из определений (1) и (2) следует, что для изотермич. процесса С = ,, для адиабатич. процесса С = 0.
Теплоемкость газов. Вычисление теплоемкости сводится к вычислению средней энергии теплового движения отдельных молекул, к-рое складывается из поступат. и вращат. движений молекулы как целого и из колебаний атомов внутри молекулы. Молярная теплоемкость одноатомного газа равна 3R/2 (по R/2 на каждую степень поступат. движения молекулы). теплоемкость многоатомного газа в общем случае м. б. представлена суммой вкладов от отдельных видов движения-поступательного, вращательного, колебательного.
Поступательная теплоемкость рассчитывается так же, как для одноатомного газа. Вращательная и в особенности колебательная теплоемкость должны, как правило, вычисляться на основе квантовой статистики. Согласно классич. статистике, вклады в молярную теплоемкость в расчете на одну степень свободы равны: для вращат. движения R/2, для колебат. движения R. Для большинства молекул при низких и средних т-рах колебат. степени свободы вырождены и не дают вклада в теплоемкость. Напр., теплоемкость двухатомного газа при обычных т-рах равна 5R/2. Лишь при достаточно высоких т-рах возбуждаются колебания определенной частоты.
