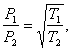- •Кинематические характеристики поступательного движения. Нормальное и тангенциальное ускорения. Зависимость кинематических величин времени.
- •Зависимость кинематических величин времени
- •Кинематические характеристики вращательного движения твердого тела
- •Законы сохранения импульса и и момента импульса
- •Закон Сохранения Импульса
- •Гармонические колебания и их характеристики. Квазиупругая сила
- •Скорость и ускорение при гармонических колебаниях.
- •Квазиупругая сила
- •Энергия гармонических колебаний
- •Простейшие колебательные системы пружинный, физический и математический маятники.
- •Сложение одинаково направленных колебаний
- •Сложение взаимно перпендикулярных колебаний
- •Затухающие колебания. Логарифмический декремент затухания
- •Вынужденные колебания. Резонанс
- •Основное уравнение молекулярно-кинетической теории идеального газа. Уравнение состояния м-к
- •Распределение максвелла. Скорости молекул
- •Барометрическая формула. Распределение Больцмана Барометрическая формула — определяет зависимость давления или плотности газа от высоты в поле тяжести
- •Распределение Больцмана — концентрация молекул газа под воздействием гравитационного поля в зависити от высоты
- •Средняя длина свободного пробега молекул. Среднее число столкновений. Понятие о вакууме.
- •Явление переноса. Диффузия, внутреннее течение, теплопроводность.
- •Внутренняя энергия идеального газа. Закон равномерного распределения по степеням свободы.
- •Первое начало в применении к изопроцессам.
- •Адиабатический процесс. Уравнение Пуассона. Работа газа при адиабатическом процессе. Адиабатическая теплоемкость.
- •Круговые процессы (циклы). Обратимый и необратимый циклы. Кпд цикла.
- •Цикл Карно и его кпд.
- •[Править]Описание цикла Карно
- •[Править]кпд тепловой машины Карно
- •Энтропия. Термодинамическое толкование энтропии. Изменение (энтропии?) в обратимых изопроцессах.
- •Статистическое толкование энтропии. Макро- и микросостояния системы. Термодинамическая вероятность.
- •Напряженность электрического поля. Графическое изображение электрических полей. Принцип суперпозиции. Поле точечного заряда. Поле диполя.
- •Теорема Гаусса для вектора напряженности электрического поля. Применение теоремы Гаусса. Поле бесконечной равномерно заряженной плоскости и системы плоскостей, шара и бесконечной нити.!!!!!!!!!!
- •Работа по перемещению заряда в электрическом поле. Циркуляция вектора напряженности. Потенциал.
- •Связь между напряженностью и потенциалом. Эквипотенциальные поверхности.
- •Виды диэлектриков. Поляризация диэлектриков.
- •Напряженность электрического поля в диэлектрике. Вектор электрической индукции. Теорема Гаусса для этого вектора.
- •Энергия электрического поля. Объемная плотность энергии.
- •Объемная плотность энергии электростатического поля
- •Магнитное поле и его характеристики.
- •Закон Био-Савара-Лапласа и его применение. Закон Био Савара Лапласа — Магнитное поле любого тока может быть вычислено как векторная сумма полей, создаваемая отдельными участками токов.
- •Циркуляция вектора индукции магнитного поля.
- •Закон Ампера. Закон Ампера — Если провод, по которому течет ток, находится в магнитном поле, то на каждый из носителей тока действует сила Ампера
- •Сила Лоренца. Действие магнитного поля на движущийся заряд.
- •Поток вектора индукции. Теорема Гаусса для вектора индукции.
- •Работа по перемещению проводника с током.
- •Ток замыкания и размыкания.
- •Энергия магнитного поля.
- •Магнитный и механический момент электрона. Гиромагнитное соотношение.
- •Атом во внешнем поле. Диа- и парамагнетизм.
- •Вектор намагничивания. Магнитное поле в веществе.
- •Ферромагнетики и их свойства.
- •Основы теории электромагнетизма Максвелла.
- •Электромагнитные волны.
- •Интерференция света. Условия интерференции.
- •Опыт наблюдения интерференции (опыт Юнга, плоская пластина, кольца Ньютона)
- •Дифракция света. Принцип Гюгенса-Френеля.
- •Дифракция Френеля (на отверстии и диске).
- •Дифракция Фраунгофера (на щели и решетке).
- •Естественный и поляризованный свет. Закон Малюса.
- •Поляризация при отражении и преломлении. Закон Брюстера.
- •Двойное лучепреломление. Поляризационные приборы.
- •Тепловое излучение и его характеристики. Закон Кирхгофа.
- •Излучение черного тела. Законы Стефана-Больцмана и Вина. Излучение чёрного тела и квантовая гипотеза.
- •Формула Релея-Джонса. Квантовая природа излучения. Формула Планка.
- •Фотоэффект. Формула Эйнштейна для фотоэффекта.
- •Эффект Комптона. Эффект Комптона — называют процесс рассеивания коротковолнового (рентгеновского) излучения на свободных электронах вещества, который сопровождается увеличением длины волны
- •Волны де Бройля.
- •Соотношение неопределенностей Гейзенберга.
- •Уравнение Шредингера. Физический смысл ψ -функции.
- •Частица в потенциальной яме.
- •Атом водорода в классической механике. Постулаты Бора.
- •Атом водорода в квантовой механике. Квантовые числа. Принцип Паули.
- •Металлы, диэлектрики, полупроводники с точки зрения зонной теории.
Барометрическая формула. Распределение Больцмана Барометрическая формула — определяет зависимость давления или плотности газа от высоты в поле тяжести
![]()
Давайте теперь узнаем, откуда же получается барометрическая формула. Давление газа на некой высоте, определяется как :
![]()
Теперь возьмем колонну в атмосфере и выделим в ней тонкий слой воздуха высотой dh. Ясно, что такой слой вызывает изменение давления на величину dP :
![]()
Знак минус необходим для того, что с увеличением высоты давление уменьшается
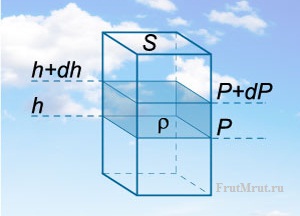
Рассматривая атмосферный воздух как идеальный газ, можно воспользоваться уравнением Менделеева — Клапейрона
![]()
Из этого уравнения выражаем давление
![]()
А теперь можно и плотность газа
![]()
Подставляя найденную плотность газа в дифференциальное уравнение dP, мы получаем :
![]()
Сделав все преобразования. мы получаем зависимость давления P от высоты подъема h. Теперь необходимо проинтегрировать обе части нашего уравнения:
![]()
Проинтегрировав, у нас полечилась вот такое уравнение:
![]()
И теперь последний рывок, это взять логарифм. И у нас получится Барометрическое уравнение.
В Формуле мы использовали :
![]() —
Давление газа
(атмосферное)
—
Давление газа
(атмосферное)
![]() —
Давление газа
над уровнем моря
—
Давление газа
над уровнем моря
![]() —
Высота над
уровнем моря
—
Высота над
уровнем моря
![]() —
Плотность газа
—
Плотность газа
![]() — Ускорение
свободного падения
— Ускорение
свободного падения
![]() — Постоянная
Больцмана
— Постоянная
Больцмана
— Температура
— Масса одной молекулы
![]() — Универсальная
газовая постоянная
— Универсальная
газовая постоянная
![]() —
Молярная масса
—
Молярная масса
![]() —
Количество
вещества
—
Количество
вещества
![]() — Число
Авогадро
— Число
Авогадро
Распределение Больцмана — концентрация молекул газа под воздействием гравитационного поля в зависити от высоты
![]()
Из формулы видно, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия его молекул (чем меньше высота, тем меньше потенциальная энергия)
Если частицы находятся в состоянии хаотического теплового движения и имеют одинаковую массу и , то распределение Больцмана применимо в любом внешнем потенциальном поле, а не только в поле сил тяжести.
Так же есть формула, показывающая зависимость давления газа от высоты «Барометрическая формула«:
В Формуле мы использовали :
— Концентрация молекул на некой высоте
![]() —
Концентрация
молекул на уровне моря
—
Концентрация
молекул на уровне моря
— Высота над уровнем моря
— Плотность газа
— Ускорение свободного падения
— Постоянная Больцмана
— Температура
— Масса одной молекулы
— Универсальная газовая постоянная
— Молярная масса
— Количество вещества
— Число Авогадро
Средняя длина свободного пробега молекул. Среднее число столкновений. Понятие о вакууме.
Молекулы газа, находясь в хаотическом движения, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь l, называемым длиной свободного пробега. В общем случае длина пути между последовательными столкновениями различна, но так как мы имеем дело с очень большим числом молекул и они находятся в беспорядочном движении, то можно говорить о средней длине свободного пробега молекул <l>. Минимальное расстояние, на которое сближаются при столкновении центры двух молекул, называется эффективным диаметром молекулы d (рис. 1). Он зависит от скорости сталкивающихся молекул, т. е. от температуры газа (несколько уменьшается с ростом температуры).
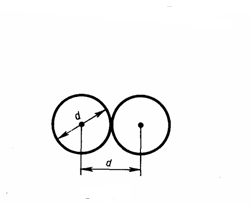
Рис.1
Так
как за 1 с молекула в среднем проходит
путь, который равен средней арифметической
скорости <v>, и если < z > — среднее
число столкновений, которые одна молекула
газа делает за 1 с, то средняя длина
свободного пробега будет
![]() Для
определения < z > представим себе
молекулу в виде шарика диаметром d,
которая движется среди других как бы
застывших молекул. Эта молекула столкнется
только с теми молекулами, центры которых
находятся на расстояниях, равных или
меньших d, т. е. лежат внутри так называемого
ломаного цилиндра радиусом d (рис.
2).
Среднее
число столкновений за 1 с равно числу
молекул в объеме, так называемого
ломаного цилиндра:
Для
определения < z > представим себе
молекулу в виде шарика диаметром d,
которая движется среди других как бы
застывших молекул. Эта молекула столкнется
только с теми молекулами, центры которых
находятся на расстояниях, равных или
меньших d, т. е. лежат внутри так называемого
ломаного цилиндра радиусом d (рис.
2).
Среднее
число столкновений за 1 с равно числу
молекул в объеме, так называемого
ломаного цилиндра:
![]() где
n — концентрация молекул, V = πd2<v>
,где <v> — средняя скорость молекулы
или путь, пройденным ею за 1 с). Таким
образом,среднее
число столкновений
где
n — концентрация молекул, V = πd2<v>
,где <v> — средняя скорость молекулы
или путь, пройденным ею за 1 с). Таким
образом,среднее
число столкновений
![]() Расчеты
показывают, что при учете движения
других молекул
Расчеты
показывают, что при учете движения
других молекул
![]() Тогда
средняя длина свободного пробега
Тогда
средняя длина свободного пробега
![]() т.
е. <l>
обратно пропорциональна концентрации
n молекул. С другой стороны, p=nkt.
Значит,
т.
е. <l>
обратно пропорциональна концентрации
n молекул. С другой стороны, p=nkt.
Значит,
![]()
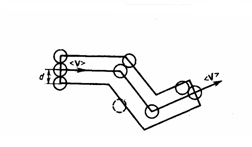
Рис.2
вакум
Газ называется разреженным, если его плотность столь мала, что средняя длина свободного пробега молекул < λ > может быть сравнима с линейными размерами l сосуда, в котором находится газ. Такое состояние газа называется вакуумом.
Различают
следующие степени вакуума: сверхвысокий
(![]() ),
высокий (
),
высокий (![]() ),
средний (
),
средний (![]() )
и низкий вакуум.
)
и низкий вакуум.
Свойства разреженных газов отличаются от свойств неразреженных газов.
Если из сосуда откачивать газ, то по мере понижения давления число столкновений молекул друг с другом уменьшается, что приводит к увеличению их длины свободного пробега. При достаточно большом разрежении столкновения между молекулами относительно редки, поэтому основную роль играют столкновения молекул со стенками сосуда.
В состоянии высокого вакуума уменьшение плотности разреженного газа приводит к соответствующей убыли частиц без изменения < λ > . Следовательно, уменьшается число носителей импульса или внутренней энергии в явлениях вязкости и теплопроводности. Коэффициенты переноса в этих явлениях прямо пропорциональны плотности газа. В сильно разреженных газах внутреннее трение, по существу, отсутствует.
Удельный тепловой поток в сильно разреженных газах пропорционален разности температур и плотности газа.
Стационарное
состояние разреженного
газа, находящегося в двух сосудах,
соединенных узкой трубкой, возможно
при условии равенства
встречных потоков частиц, перемещающихся
из одного сосуда в другой:![]() ,
где n1 и n2 –
число молекул в 1 см3 в
обоих сосудах;
,
где n1 и n2 –
число молекул в 1 см3 в
обоих сосудах;![]() и
и ![]() –
их средние арифметические скорости.
–
их средние арифметические скорости.
Если Т1 и Т2 – температуры газа в сосудах, то предыдущее условие стационарности можно переписать в виде уравнения, выражающего эффект Кнудсена:
|
|
|
|
где P1 и P2 – давления разреженного газа в обоих сосудах.