
- •Дифференцированный выбор пгс по воз и Международного
- •Антиангинальные средства
- •Противоаритмические лекарственные средства.
- •Лекарственные средства для лечения сердечной недостаточности
- •Психотропные лекарственные средства
- •Антибиотики
- •Лекарственные средства применяемые в пульмонологии
- •Противовоспалительные средства (пвс)
- •Пэ иммунодепрессантов Табл. 3
- •Сравнительная характеристика активности гкс Табл. 2
Антибиотики
Подсчитано, что в 1997 г антибиотиков (А) в мире продано на 17 млр.долларов, из них потрачено 12 млр на амбулаторное лечение. Почти каждый седьмой житель планеты 1 раз в год принимает А. Особенно последние часто используются в пульмонологии. В 1997 г выписано 818 млн рецептов на А. для лечения дыхательных путей.
Среди достижений лечебной медицины в ХХ в приоритет принадлежит созданию А. Эти средства (наряду с химиопрепаратами) действуют на причину заболевания. Данное обстоятельство накладывает огромную ответственность на медицинских работников в плане решения о назначении А., выбора препарата, длительности применения и т.д. От адекватности этого зависит не только здоровье, но и нередко и жизнь пациента.
Когда в начале 40-х годов ХХ столетия группой английских ученых был получен пенициллин, то казалось, что найдена «волшебная пуля» П. Эрлиха, которая убивает микроорганизм, не затрагивая ткани человека. Однако уже спустя 7 лет французские ученые обобщили опыт применения пенициллина в монографии под темпераментным названием «Злодеяния антибиотиков».
После 60 лет применения А мы имеем наряду с выдающимися достижениями в лечении инфекционно-зависимых болезней также нежелательные последствия:
рост множественных штаммов микроорганизмов
возрастание удельного веса в патологии условно-патогенной и вирусной инфекции
увеличение частоты вялотекущих атипичных инфекционных процессов
возникновение побочных эффектов А.
В настоящее время наиболее актуальным последствием применения А считается
рост устойчивости микроорганизмов к ним. Важно выделить при этом две особенности:
данное последствие можно оценить только ретроспективно спустя многие годы
при применении одного А развивается устойчивость еще к 3-4 другим препаратам из-за схожести механизмов этого процесса.
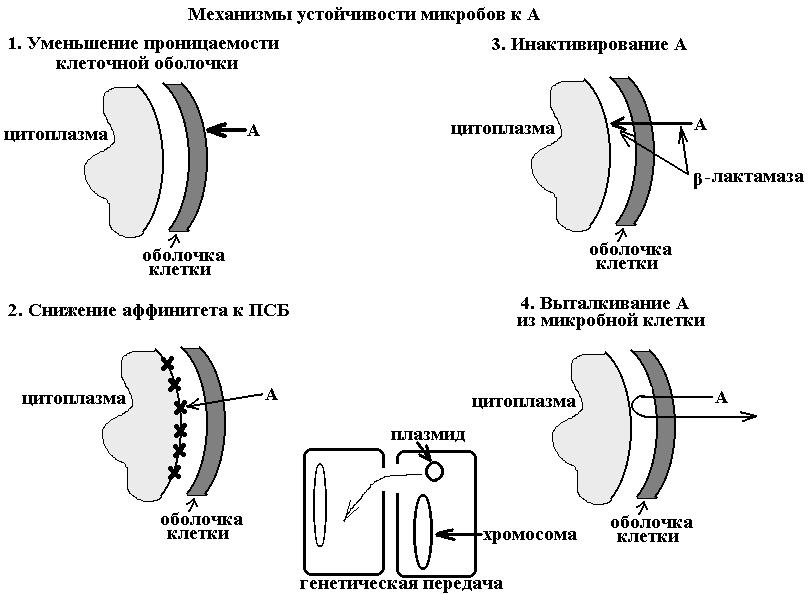
Различают 4 механизма устойчивости (см. схему):
инактивирование А путем образования микробами ферментов
изменение проницаемости клеточной оболочки микроба
уменьшение аффинитета (сродства) А к соответствующему рецептору
образование своеобразной помпы, выталкивающей А из микробной клетки.
Резистентность формируется путем мутации устойчивых штаммов микробов и пу-
тем генетической передачи через хромосомы и плазмиды (см. схему).
Факторы риска развития резистентности к А микробов полностью не раскрыты, но главное - это нерациональное применение этих ЛС.
В педиатрии существенную роль в формировании устойчивости к бета-лактамным А приписывают применению их внутрь курса лечения более 5 дней и назначению препарата в низких дозах (относительный риск развития устойчивости равен соответственно 3, 3.5 и 5.9).
КЛИНИКО-ФАРМАКОЛОГИЧЕСКИЕ ТРЕБОВАНИЯ К А:
селективное подавление патогенных микробов
бактерицидный тип действия
медленное развитие устойчивости микробов к А
иметь устойчивость к бета-лактемазам
иметь длительный Т-50 (прием 1-2 раза в сутки
максимальное накопление в зоне воспаления (макролиды II поколения)
не повреждать воспаленную ткань (орган)
сохранять устойчивость к продуктам распада ткани и микробов (минимально пенициллины, максимально фторхинолоны)
при грам «-« инфекции предупреждать развитие эндотоксического шока (имипенем)
выпускаться в различной форме с целью ступенчатой антибиотикотерапии (АБТ)
должно быть соответствие между стоимостью и эффективностью.
Человек контактирует с огромным количеством микробов, абсолютное большинство которых является союзниками животных и при их подавлении может развиться суперинфекция. Прием А 1-2 раза в сутки удобно для пациента и главное в течение суток поддерживается равномерно бактерицидная или бактериостатическая концентрация препарата, что предупреждает селекцию устойчивых штаммов. При парентеральном введении есть экономический эффект. Для снижения стоимости применения А предлагается суперчатый метод терапии (при начинающем снижении лихорадки через 2-3 дня переходят на тот же А для приема внутрь или заменяют родственным). Такой подход сам по себе уменьшает стоимость АБТ на 30-60%. Важно оценить соответствие между стоимостью и эффективностью. Если оно для имипенема равно 2.5, а для меропенема - 4.3, то ясно какому А отдать предпочтение.
Страчунский Л.С. приводит прогнозируемую стоимость ( в долларах США) амбулаторного лечения острой пневмонии:
пенициллин парентерально 45
ципрофлоксацин 19.8
офлоксацин 17.8
аугментин 15.2
ампициллин 12
цефалексин 9.6
азитромицин (сумамед) 8 долларов США
Цифры приводятся с учетом работы медработника и затрат на шприцы, спирт и т.д. В некоторых случаях это может превышать стоимость самого ЛП. Внутривенное введение стоит 0.87$, внутримышечное - 0.09$. К большому сожалению это не учитывается врачами.
А. классифицируют по нескольким критериям: по механизму действия, по химическому строению, спектру и силе действия. По механизму действия А (см. схему) подразделяют на 4 группы (сокращенном виде):
ингибиторы синтеза клеточной оболочки микробов на одной из последних стадий сборки пептидогликанов. В этом принимает участие карбоксипептидаза. Бета-лактамный А имеет структурное сходство с субстратом (Д-ала-Д-ала) и связывается с пенициллинсвязывающим белком (ПСБ) в центре фермента, предназначенного для субстрата. Происходит конкурентное торможение образования пептидогликанов, что способствует поступлению жидкости в микроб и ее гибели. В последнее время предполагается, что бета-лактамные А нарушают синтез адгезивных белков, способствующих связыванию микроба с клеткой микроорганизма. Гликопротеидные А (ванкомицин, ристомицин) имеют иной механизм действия. Известно, что ванкомицин образует комплексы с полимерами бактерий оболочки
А нарушающие функцию клеточной мембраны. Это полимексин и полиены
ингибиторы синтеза НК:
Блокаторы матричных функций ДНК - противоопухолевые А;
Блокаторы РНК-полимеразы (нарушается транскрипция) - рифампицин;
Блокаторы ДНК-полимеразы (нарушается репликация) - фторхинолоны.
ингибиторы синтеза белка, что нарушает сборку пептидной цепи на рибосомах:
аминогликозиды нарушают последовательность включения аминокислот в пептидной цепи, макролиды блокируют в пептидной цепи, макролиды блокируют наращивание цепи, линкозамиды нарушают синтез пептидов в начале сборки, тетрациклины блокируют синтез транспортной РНК, а хлорамфеникол нарушает формирование связей между отдельными пептидами.
Бета-лактамные А подразделяются на:
пенициллины
цефалоспорины
новые бета-лактамные А (см. табл.)
Группа пенициллина имеет несколько поколений. В связи с тем, что уже в 50-х годах появились пенициллиноустойчивые штаммы стафилококка, возросла патогенная роль синегнойной палочки (СГП) ученые стремились создать А., действующие на эти микробы.
В 1955 г выделено ядро пенициллина-6-аминопенициллиновая кислота и к 1960 году созданы три группы полусинтетических А:
оксациллин, устойчивый к стафилококковой бета-лактамазе
карбенициллин действующий на синегнойную палочку;
ампициллин, обладающий широким спектром действия.
Оксациллин устойчив к бета-лактамазе благодаря наличию боковой ацильной группы, защищающей бета-лактамное кольцо от разрушения.
Это резервный А для лечения стафилококковой инфекции, устойчивой к пенициллину.
ГРУППЫ -лактамных АНТИБИОТИКОВ Табл. 1
I II III


Гр. Пенициллина Гр. Цефалоспоринов Новые -лактамы
Первое поколение Первое поколение 1. Монобактамы


бензилпенициллин - активны против грамм «+» Азтреонам
бензаминпенициллин микробов -цефалексин
ФАУ - пенициллин
2. Карбапенемы
 Второе
поколение Второе поколение
Второе
поколение Второе поколение

 Имипенем,
меропенем
Имипенем,
меропенем
Полусинтетические - активны против грамм «+»
с расширенным спектром и грамм «-« микроорганизмов
действия - ампициллин, (цефаклор, цефуроксим)
амоксициллин
устойчивые к стафилоко- Третье поколение
 кковой --лактамазе
- окса-
кковой --лактамазе
- окса-
циллин - активны против грамм «-«
действующие на СГП - карбе- палочек (цефотаксим, цефапе-
нициллин разон, цефтазидин )
Третье поколение Четвертое поколение


Уреидопенициллины - активны против грамм «+»
азлоциллин, пиперациллин, микробов (цефепим)
действуют на СГП, широкий
спектр
Защитные пенициллины
ко-амоксиклав (аугментин,
амоксиклав)
ампициллин/сульбактам
Карбенициллин в настоящее время почти не применяется, т.к. в аптеках появились значительно более эффективные А для подавления СГП.
Аминопенициллины имеют более длительный Т-50, устойчивы к действию желудочного сока. Из-за низкой биодоступности ампициллина (<50%) часто развивается дисбактериоз кишечника, в то время как его активный метаболит-амоксициллин, биодоступность которого превышает 90%, дисбактериоз вызывает редко, но в 1-2 раза эффективней своего прародителя.
Третье поколение пенициллинов - уреидопенициллины (азлоциллин, пиперациллин и др.) обладает очень широким спектром действия и прежде всего они активны против СГП, но чувствительны к бета-лактамазе. Используются очень редко.
Комбинированные пенициллины. Советский препарат ампиокс (комбинация ампициллина с оксациллином в соотношении 2:1) рассчитан на то, что оксациллин инактивирует бета- лактамазу и вместе с ампициллином убивает микроорганизмы. Однако более поздние исследования показали, что в данной комбинации не происходит разрушения или связывания бета-лактамазы, а лишь вследствие наличия боковой цепи оксациллин защищен от действия фермента, тогда как ампициллин разрушается последним, а оставшийся второй компонент комбинации содержит дозу ниже минимально подавляющей концентрации (МПК). В настоящее время от ампиокса отказались.
За рубежом пошли по другому пути - созданием защищенных аминопенициллинов. Из микроорганизмов добыты вещества похожие на бета-лактамы, сохраняющие небольшую противомикробную активность, но, главное, они отвлекают на себя бета-лактамазу, ведя к необратимой (суицидной) инактивации фермента (см. схемы). Созданы Ко-амоксиклав (амоксиклав, аугментин) - комбинация амоксициллина с клавулановой кислотой и ампициллина с сульбактамом (уназин). Эффективность первого выше.
Группа цефалоспоринов (Ц). По сравнению с пенициллином Ц обладают:
более широким спектром действия
более длительным Т-50
устойчивостью к бета-лактамазе (большинство)
реже дают аллергические реакции
они более дорогие.
На сегодняшний день уже имеются 4 поколения Ц в зависимости от спектра действия.
1-ое поколение обладает противостафилококковой активностью, устойчивых к пенициллину, действует также на стрептококки (кроме энтерококков), гонококки. Наиболее известен цефазолин.
2-ое поколение действует на стафилококки, а также на кишечную палочку, протей, клебсиеллу. Применяются цефаклор (внутрь), цефураксим (внутрь и парентерально). Они устойчивы к бета-лактамазе.
3-е поколение Ц имеет более широкий спектр действия и сильнее подавляет грамм «-« палочки, устойчивы к бета-лактамазам (цефотаксим, цефаперазон, цефтазидим и др.) Препараты 3-го поколения Ц являются средствами близкого резерва для госпитальной или другой тяжелой инфекции. Препараты менее активны в отношении грамм «+» микроорганизмов.
4-ое поколение Ц обладают высокой активностью к анаэробным бактериям, к бактериозам, стабильны к бета-лактамазам, хорошо проникают внутрь клетки. Более активны по сравнению с Ц 3-го поколения в отношении грамм «+» микроорганизмов
Первым представителем 4-го поколения Ц оказался цефепим (максипим). Его клинико-фармакологические особенности:
широкий спектр действия, включающий штаммы, устойчивые к Ц 3-го поколения
высокая устойчивость к бета-лактамазам
низкая вероятность развития резистентности микробов. Так, устойчивость СГП наблюдается у 25%, тогда как к цефпирону у 56%, цефтазидиму у 75, цефатоксиму у 91%
выраженное сродство (аффинитет) к ПСБ подобно карбапенемам
лечение осложненных интраабдоминальных инфекций в сочетании с метронидазолом экономически более выгодно чем лечение имипенемом, причем клинический и бактериологический эффекты (эрадикация бактерий) выше
применяется 2 раза в сутки.
Новые бета-лактамы. Тиенамицины. Имипенем внедрен в клинику с 1986 г. В связи с тем, что этот А разрушается протеолитическим ферментом почек, что требует частого введения препарата, к нему присоединили ингибитор этого фермента целастатин натрия и препарат получил фирменное название ТИЕНАМ. По ФКК обе составные части близки. Целостатин обладает нефропротективным действием.
Особенности имипенема:
очень широкий спектр действия, универсальный А (эталонный)
быстрое, интенсивное проникновение через оболочку грамм «-« бактерий вследствие малых размеров А и вследствие свойств цвиттериона (благодаря наличию положительного и отрицательного заряда происходит соответствующая пространственная ориентация)
устойчив к бета-лактамазам за счет положения гидроксилэтиловой группы вместо «ЦИС» в «ТРАНС»
имеет постантибиотический период
на 30-35% снижает высвобождение бактериями эндотоксина, что предупреждает развитие эндотоксического шока. Это происходит вследствие того, что А приостанавливает жизнедеятельность микробов (вызывает филаментацию бактерий за счет селективного взаимодействия с ПСБ-2), что уменьшает синтез токсина
низкая частота развития устойчивости, т.к. хотя максимально связывается с ПСП-2, но также блокирует остальные рецепторы
отсутствие перекрестной резистентности с др. бета-лактамными А
обладает некоторым иммуномодулирующим эффектом
Показания к имипенему:
множественно устойчивая тяжелая внутригоспитальная инфекция
отсутствие эффекта эмпирической АБТ при тяжелом состоянии больного (чаще в палатах интенсивного наблюдения)
внутрибрюшная патология, особенно с нарушенным иммунитетом
осложненная инфекция мочевых путей (особенно СГП).
С 1994 г появился второй А из группы карбапенемов (тиенамицинов) - меропенем (меронем). Сроки наблюдения пока небольшие.
Известно, что в отличие от имипенема не провоцирует судорожный синдром:
можно назначать при беременности
в 5-10 раз сильнее действует на грам «-« палочки
более дорогой
Из новых бета лактамов следует отметить группу монобактамов (без тиазолидинового кольца). Это препарат азтреонам (азактам).
Препарат высокоэффективен против грамм «-« микробов, в т.ч. против СГП. Устойчив к бета-лактамазе. Не действует на грамм «+» бактерии. Является резервным А.
Аминогликозиды. Первое поколение - стрептомицин, канамицин. В настоящее время используется для лечения ТБЦ.
Второе поколение - гентамицин. Оптимисты приводят следующие положительные особенности его:
быстрый эффект
дозозависимое бактерицидное действие
широкий спектр действия
синергизм с бета-лактамными А
высокая эффективность
низкая степень развития резистентности
не высокая стоимость
Эту блестящую характеристику омрачают следующие факты:
незначительная чувствительность к гентамицину пневмококков
сформировался достаточно высокий уровень устойчивости у этому А как амбулаторной, так и госпитальной инфекции
токсичность препарата
Третье поколение - амикацин и производное сизомицина - нетилмицин. Показаны при гентамицинустойчивой инфекции, для лечения госпитальной инфекции, (лучше фторхинолоны и Ц 3-4 поколения, при аллергии в бета-лактамным А. Нетилмицин имеет постантибиотический период, применяется 1 раз в сутки, ингибирует бета-лактамазу. Слабо действует на стрептококки.
Из группы тетрациклина для лечения инфекций пригоден доксициклин. По сравнению с тетрациклином:
выше всасываемость при приеме внутрь (90% против 60-80%)
отсутствие влияния пищи и молока на всасывание
Т-50 18 ч - прием 1-2 раза в сутки
высокое накопление в тканях (за счет большей липофильности)
безопасен при ХПН, т.к. выводится печенью
Препарат назначают при микоплазменной и хламидийной инфекции, передающейся половым путем, а также используется в качестве альтернативного препарата при инфекции дыхательных путей, и в ряде стран Запада используется как средство 1-го ряда для лечения хронического бронхита, не тяжелых пневмоний.
К тетрациклину микробы более чем в 50% устойчивы. В РБ он используется из-за дешевизны. Тетрациклины не назначают беременным и детям до 8 лет, т.к. он откладывается в зубах, костях. Доксициклин используют для лечения артрозов. т.к. он блокирует синтез генов металлопротеаз.
МАКРОЛИДЫ. Препаратом 1-го поколения является эритромицин, применяющийся в клинике с начала 50-х годов. В конце 80-х годов появились макролиды второго поколения: природные (джосамицин, мидекамицин, спирамицин); полусинтетические (азитромицин, рокситромицин, кларитромицин). У эритромицина имеется целый ряд недостатков:
относительно узкий спектр действия
нестабильное всасывание
Т-50 короткий
влияние на эффекты других лекарств
частые ПЭ, особенно со стороны ЖКТ
Из второго поколения в настоящее время наиболее популярны: азитромицин (сумамед) и клариромицин (клацид). Первый действует на внутриклеточные, а второй на вне- и внутриклеточные микробы. Азитромицин 15 членный макролид, содержит азот - первый представитель подкласса азалидов, создан в лаборатории «Плива» под руководством профессора Джокича.
По сравнению с эритромицином:
имеет более широкий спектр действия, против грам»-« бактерий, активность выше в 10-15 раз
более устойчив к кислой среде желудка
токсичность ниже, переносимость выше
концентрация в воспаленной ткани значительно выше
есть постантибиотический период до 5-7 дней (у кларитромицина меньше)
длительный Т-50 (принимаются все макролиды 2-го поколения 1-2 раза в сутки)
ПЭ у эритромицина наблюдаются у 21-32%, кларитромицина - у 16-29%, у джосамицина у 8-13%, азитромицин - у 6-9:, рокситромицин - у 3-4% (данные на 1998 г.).
Некоторые макролиды 2-го поколения обладают заметным противовоспалительным действием, в частности, рокситромицин. Предполагается, что это происходит вследствие торможения этим А синтеза ряда провоспалительных цитокинов. Есть данные об активации гипоталамо-гипофизорно надпочечниковой системы. Повышают функцию нейтрофилов. Приписывают им даже иммуномодулирующее действие.
Эти группы А наиболее показана детям, являются резервными А при бронхопульмональной инфекции, эффективны при хламидиях, микоплазме.
Выяснены три механизма развития устойчивости к макролидам:
модификация мишени действия в бактериальной клетке
активное выталкивание А из микробной клетки
инактивация макролидов бактериальными бета-лактамазами
Прокинетические действие макролидов осуществляется через рецепторы, чувствительные к мотилину.
ФТОРХИНОЛОНЫ не являются А, по фармакологическим параметрам системные препараты стоят близко к А. Это синтетические производные хинолонов. В настоящее время применяются препараты третьего поколения, содержащие фтор. Данный галоген усилил противомикробный эффект, расширил спектр действия при улучшенной переносимости.
ОБЩИЕ ОСОБЕННОСТИ ФТОРХИНОЛОНОВ:
широкий спектр действия (на их базе разрабатываются противовирусные и противоопухолевые средства
высокая активность
хорошая переносимость
низкий риск развития резистентности
отличная проникающая способность к месту воспаления
длительный Т-50
устойчивы к продуктам распада
принимаются внутрь и парентерально (важно для ступенчатой АБТ).
Недостатком является неэффективное действие на пневмококк.
Различают одно-фтористые: (офлоксацин, ципрофлоксацин (эталонный препарат), пефлоксацин), двуфтористый (ломефлоксацин (активен при туберкулезе), трехфтористый (флероксацин).
Содержащийся в хинолонах фтор может связывать ГАМК и способен спровоцировать судорожный синдром при наличии факторов риска, а у детей, откладываясь в метафизе костей, нарушает процессы роста. В обеих случаях фторхинолоны противопоказаны.
ПРИНЦИПЫ РАЦИОНАЛЬНОЙ АБТ:
устранение всего, что мешает разрешению процесса (дренаж)
обоснование назначение А (бактериальная инфекция)
адекватный выбор препарата с учетом специфичности действия, способности накапливаться в зоне воспаления, безопасности
оценка эффективности в первые 24-48 ч
при отсутствии эффекта правильная замена (иной спектр и механизм действия)
продолжительность АБТ 2-4 дня после нормализации температуры (исключение при урологической инфекции, сепсисе, инфекционном эндокардите)
учет фармакоэкономики
определение показаний к комбинированной АБТ
Для успешной АБТ требуется:
правильно выбранный препарат
правильно выбранная доза
соблюдение интервала введения
ступенчатая терапия
своевременное начало лечения
Ошибки врачей при АБТ:
назначение А без показаний
несвоевременная оценка эффективности
неадекватный выбор А
излишняя продолжительность применения
нет соблюдения режима дозирования
неоправданная приверженность к комбинациям
ПЭ. Рациональное применение А на 50% уменьшают риск проявления ПЭ, а по нашим данным, еще и чаще. Различают 4 группы ПЭ:
аллергические
токсические
суперинфекционные
другие проявления (синдром желудочной или кишечной диспепсии, геморрагический синдром, боли в сердце, гепатотоксичность и т.д.)
А являются главной причиной аллергических осложнений лекарственной терапии от различных кожных сыпей, лейкопении до анафилактического шока. Аминогликозиды обладают токсическим эффектом на почки и внутреннее ухо, рифампицин и тетрациклин - на печень, хлорамфеникол - на красную кровь.
Суперинфекция чаще всего развивается при использовании А широкого спектра действия (ампициллин, тетрациклин, линкозамиды), при длительном применении, при наличии сопутствующей патологии (особенно сахарный диабет), на фоне лечения ГКС. Линкозамиды чаще других А дают псевдомембраназный колит.
Геморрагический синдром при применении цефалоспоринов может возникать вследствие нарушения всасывания витамина «К» в кишечнике, антисинегнойные пенициллины нарушают функцию мембраны тромбоцитов, а метронидазол вытесняет кумарины из связи с белком, при совместном применении.
