
- •1.Понятие об идеальном газе, Законы и уравнения состояния идеального газа
- •2.Внутренняя энергия, работа и теплота в термодинамике. Теплоёмкость вещ-ва. Работа расширения газа
- •3. Вероятность и флюктуации. Распределение Максвелла и его Зависимость от температуры. Среднее значение скоростей и наиболее вероятная скорость
- •4.Распределение числа частиц по высоте.Распределение Больцмана.Распределение Максвелл-Больцмана
- •5. Реальные газы. Уравнение Ван-дер-Вальса. Критическое состояние. Эффект Джоуля-Томсона
- •6.Изотермы Эндрюса и Ван-Дер-Ваальса. Метастабильные сотояния. Физический смысл критического сотояния
- •7.Фазы и компоненты. Условие равновесия фаз. Фазовые переходы первого и второго уровня
- •8.Уравнение Клапейрона-Клаузиуса. Фазовые диаграммы. Тройная точка
- •9. Понятие о физической кинетике. Время релаксации. Эффективное сечение рассеяния. Средняя длина свободного пробега
- •10. Строение кристаллов. Точечные дефекты в кристаллах:вакансии.Примеси внедрения,замещения
- •11. Элементы зонной теории кристаллов.Заполнение зон:металлы,диэлектрики,полупроводники
- •12.Полупроводники.Понятие дырочной проводимости.Собственные и примесные полупроводники
- •13. Электрический ток в вакууме.Термоэлектронная эмиссия
6.Изотермы Эндрюса и Ван-Дер-Ваальса. Метастабильные сотояния. Физический смысл критического сотояния
Д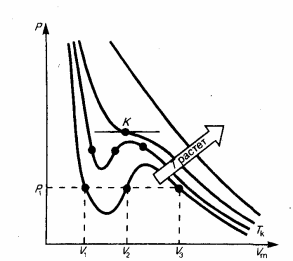 ля
исследования поведения реального газа
рас-м изотермы
Ван-дер-Ваальса
— кривые зависимости р
от Vm
при заданных Т,
определяемые уравнением Ван-дер-Ваальса
для моля
газа.При высоких темп-рах (T
> Tк)
изотерма реального газа отличается от
изотермы идеального газа только некоторым
искажением ее формы, оставаясь монотонно
спадающей кривой. При некоторой
температуре Tк
на изотерме имеется лишь одна точка
перегиба К.Эта
изотерма
называется критической(Tк
); точка перегиба К
называется критической точкой.Соответствующие
этой точке объем
Vк,
и давление
рк
называются также критическими.
Состояние с критическими параметрами
(pк,
Vк,
Tк)
называется критическим
состоянием.
При низких темп-рах (Т
< Tк
) изотермы имеют волнообразный участок.Для
пояснения характера изотерм преобразуем
уравнение Ван-дер-Ваальса к виду
ля
исследования поведения реального газа
рас-м изотермы
Ван-дер-Ваальса
— кривые зависимости р
от Vm
при заданных Т,
определяемые уравнением Ван-дер-Ваальса
для моля
газа.При высоких темп-рах (T
> Tк)
изотерма реального газа отличается от
изотермы идеального газа только некоторым
искажением ее формы, оставаясь монотонно
спадающей кривой. При некоторой
температуре Tк
на изотерме имеется лишь одна точка
перегиба К.Эта
изотерма
называется критической(Tк
); точка перегиба К
называется критической точкой.Соответствующие
этой точке объем
Vк,
и давление
рк
называются также критическими.
Состояние с критическими параметрами
(pк,
Vк,
Tк)
называется критическим
состоянием.
При низких темп-рах (Т
< Tк
) изотермы имеют волнообразный участок.Для
пояснения характера изотерм преобразуем
уравнение Ван-дер-Ваальса к виду
![]() Уравнение
при заданных р
и Т
является уравнением третьей степени
относительно Vm.Первому
случаю соответствуют изотермы при
низких темп-рах (три значения объема
газа V1,
V2
и V3
отвечают одному значению давления р1),
второму случаю -изотермы при высоких
темп-рах.Вещество в газообразном
состоянии при температуре ниже критической
называется паром, а пар, находящийся в
равновесии со своей жидкостью, называется
насыщенным.
Данные выводы, следующие из анализа
уравнения Ван-дер-Ваальса, были
подтверждены опытами ирландского
ученого Т. Эндрюса.Отличие экспериментальных
(Эндрюс) и теоретических (Ван-дер-Ваальс)
изотерм заключается в том, что превращению
газа в жидкость в первом случае
соответствуют горизонтальные участки,
а во втором — волнообразные. Для
нахождения критических параметров
подставим их значения в уравнение и
запишем
Уравнение
при заданных р
и Т
является уравнением третьей степени
относительно Vm.Первому
случаю соответствуют изотермы при
низких темп-рах (три значения объема
газа V1,
V2
и V3
отвечают одному значению давления р1),
второму случаю -изотермы при высоких
темп-рах.Вещество в газообразном
состоянии при температуре ниже критической
называется паром, а пар, находящийся в
равновесии со своей жидкостью, называется
насыщенным.
Данные выводы, следующие из анализа
уравнения Ван-дер-Ваальса, были
подтверждены опытами ирландского
ученого Т. Эндрюса.Отличие экспериментальных
(Эндрюс) и теоретических (Ван-дер-Ваальс)
изотерм заключается в том, что превращению
газа в жидкость в первом случае
соответствуют горизонтальные участки,
а во втором — волнообразные. Для
нахождения критических параметров
подставим их значения в уравнение и
запишем
![]() .
Поскольку в критической точке все три
корня совпадают и равны Vк
уравнение приводится к виду
.
Поскольку в критической точке все три
корня совпадают и равны Vк
уравнение приводится к виду![]()
![]() Tax
как эти уравнения тождественны, то в
них должны быть равны и коэф-ты при
неизвестных соответствующих степеней.
Поэтому можно записать
Tax
как эти уравнения тождественны, то в
них должны быть равны и коэф-ты при
неизвестных соответствующих степеней.
Поэтому можно записать
![]() Решая
полученные уравнения, найдем
С
Решая
полученные уравнения, найдем
С равнивая
изотерму Ван-дер-Ваальса с изотермой
Эндрюса (верхняя кривая на рис2), видим,
что последняя имеет прямолинейный
участок 2—6,
соответствующий двухфазным состояниям
вещества. Правда, при некоторых условиях
могут быть реализованы состояния,
изображаемые участками ван-дер-ваальсовой
изотермы 5—6
и 2—3.
Эти неустойчивые состояния называются
метастабильными
равнивая
изотерму Ван-дер-Ваальса с изотермой
Эндрюса (верхняя кривая на рис2), видим,
что последняя имеет прямолинейный
участок 2—6,
соответствующий двухфазным состояниям
вещества. Правда, при некоторых условиях
могут быть реализованы состояния,
изображаемые участками ван-дер-ваальсовой
изотермы 5—6
и 2—3.
Эти неустойчивые состояния называются
метастабильными
7.Фазы и компоненты. Условие равновесия фаз. Фазовые переходы первого и второго уровня
Очевидно, что для равновесия фаз, как и для равновесия любых частей сис-мы, должны быть равными их темп-ры: T1 = T2 .Кроме того, условие непожвижности границы между фазами требует равенства их давлений: P1 = P2 .Однако этого недостаточно для равновесия фаз.Равновесие 2 фаз достигается при = их химических потенциалов.В веществе, состоящем из k компонент, одновременно могут сущ-ть не более чем k + 2 равновесные фазы. Переход между жидким и газообразным состояниями был назван фазовым переходом первого рода. Переход жидкость-твердое тело также является фазовым переходом первого рода.При рассмотрении гелия нам встретился другой тип фазового перехода - λ-переход(фазовый переход второго рода).Особенностью фазовых переходов первого рода является скачкообразное измен-е удельной внутренней энергии и связанных с ней величин в точке перехода и наличие скрытой теплоты перехода.Темп-ра, при которой осуществляется фазовый переход, называется точкой Кюри. Поскольку переход реализуется сразу во всем объеме, не существует пространственного разделения фаз и их нахождения в равновесии друг с другом.Фазовый переход второго рода не сопровождается выделением или поглощением теплоты фазового превращения.Объем при переходе не меняется, но теплоемкость в связи с измен-ем симметрии сис-мы меняется. Это означает, что производная dСv/dТ меняется скачком, как и температурный коэф-т объемного расширения, хотя сам объем постоянен.
