
- •1.Определение химии как науки: объекты и область изучения.
- •2. Определение химической технологии как науки.
- •8. Открытие радиоактивности.
- •9. Опыт Резерфорда по рассеянию Альфа-лучей на металлической фольге.
- •12. Атомная модель Бора.
- •15. Корпускулярно-волновая двойственность света.
- •16. Опыты Девиссона и Джермера по интерференции на основе дифракции электронов.
- •17. Волны де Бройля.
- •18. Принцип неопределенности Гейзенберга.
- •19. Уравнение Шредингера
- •20. Принцип Паули.
- •21. Правило Хунда.
- •22. Попытки классификации химических элементов по их свойствам.
- •23. Триады Деберейнера.
- •24. Октавы Ньюлендса.
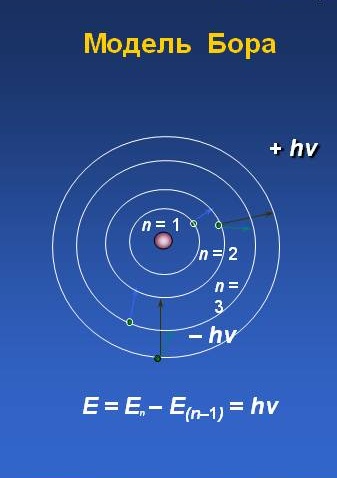
12. Атомная модель Бора.
Бо́ровская
моде́ль а́тома (Моде́ль Бо́ра) —
полуклассическая модель атома,
предложенная Нильсом Бором в 1913 г. За
основу он взял планетарную модель атома,
выдвинутую Резерфордом. Однако, с точки
зрения классической электродинамики,
электрон в модели Резерфорда, двигаясь
вокруг ядра, должен был бы излучать
непрерывно, и очень быстро, потеряв
энергию, упасть на ядро. Чтобы преодолеть
эту проблему Бор ввел допущение, суть
которого заключается в том, что электроны
в атоме могут двигаться только по
определенным (стационарным) орбитам,
находясь на которых они не излучают, а
излучение или поглощение происходит
только в момент перехода с одной орбиты
на другую. Причем стационарными являются
лишь те орбиты, при движении по которым
момент количества движения электрона
равен целому числу постоянных Планка.
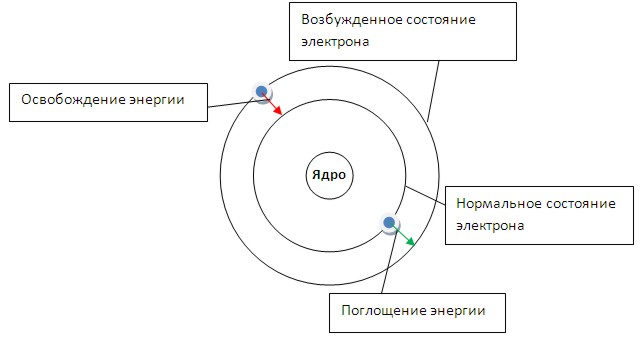
Энергия электрона зависит от радиуса
его орбиты. Минимальная энергия у
электрона, который находится на ближайшей
к ядру орбите. При поглощении кванта
энергии электрон переходит на орбиту
с более высокой энергией (возбужденное
состояние). И наоборот, при переходе с
высокого энергетического уровня на
более низкий - электрон отдает (излучает)
квант энергии.
13. Арнольд Иоганнес Вильгельм Зоммерфельд (5 декабря 1868, Кёнигсберг — 26 апреля 1951, Мюнхен) — немецкий физик-теоретик и математик. Согласно атомной модели Бора электроны движутся вокруг ядра атома по круговым орбитам. В соответствии же с положениями, выдвинутыми Зоммерфельдом, электроны совершают движение по эллиптическим орбитам. В атомной модели Бора - Зоммерфельда р-электроны совершают движение по эллиптическим орбитам; оси трех атомных р-орбит б этой модели соответствуют большим осям эллипсов.

14. Квантовые числа по Бору-Зоммерфельду.
Квантовое число в квантовой механике — численное значение какой-либо квантованной переменной микроскопического объекта (элементарной частицы, ядра, атома и т. д.), характеризующее состояние частицы. Задание квантовых чисел полностью характеризует состояние частицы. Квантовые идеи использовались только для вычисления интенсивностей компонентов расщепления. Важный шаг в этом направлении был сделан Зоммерфельдом, который в 1915 году обобщил теорию атома водорода на случай электронных орбит с несколькими степенями свободы. При этом вместо единственного квантового условия (квантование момента импульса) он постулировал, что «фазовый интеграл» для каждой обобщённой координаты (Qk) и соответствующего импульса (Pk) равен целому числу (Nk) квантов действия. Обобщённые квантовые условия такого вида, часто называемые условиями Бора — Зоммерфельда, были независимо получены Уильямом Уилсоном и Дзюном Исиварой. Однако, в отличие от этих учёных, Зоммерфельд успешно применил полученные условия к описанию атомных спектров. Первым вопросом, который он рассмотрел, стала задача о неподвижной плоской эллиптической орбите электрона в атоме водорода (две степени свободы). Записав свои квантовые условия в полярных координатах и введя азимутальное и радиальное квантовые числа (такими терминами были обозначены соответствующие числа ). Зоммерфельд получил формулу для энергии электрона на стационарной орбите. Это выражение давало те же уровни энергии, что и формула Бора для круговых орбит; энергия уровней зависела лишь от суммы азимутального и радиального квантовых чисел, названной главным квантовым числом.
