- •І рівень
- •6.За рисунком опишіть геохімічний цикл води.
- •14.Наведіть приклади буферів кислотності в геохімічних системах.
- •17.Наведіть приклади геохімічних кислотно-основних буферів.
- •19.Наведіть приклади геохімічних систем із конвективними потоками речовини.
- •20.Наведіть приклади гідратаційних комплексів. Гідратація іонів у водному розчині –
- •22.Наведіть приклади кислот і основ у геохімічних процесах
- •23.Наведіть приклади метастабільних фаз
- •І рівень Питання Друге
- •6.Що таке ефект висолювання?
- •І рівень Питання Третє
- •5.Що таке іонний обмін? Іонний обмін в адсорбційних системах
- •6.Що таке кислотно-основні взаємодії?
- •7.Що таке кінетичний поріг процесу
- •9.Що таке коефіцієнт активності розчинних компонентів?
- •12.Що таке консервативні і неконсервативні іони?
- •16.Що таке механізм реакції?
- •18.Що таке носій хімічного елементу? Приклади
- •21.Що таке окисник і відновник? Приклади
- •22.Що таке окисно-відновні взаємодії
- •Іі рівень
- •1 Питання
- •4.Геохімічна класифікація елементів Геохімічні класифікації елементів
- •Геохімічна класифікація Гольдшміта, Вернадського, Беуса
- •5.Геохімія радіоактивних ізотопів в системах Rb-Sr та Sm-Nd(див. Лекція 12)
- •6.Гідратизація поверхні мінералу та точка нульового заряду Коефіцієнт активностіповерхні та гідратизація поверхні
- •9.Дайте характеристику основних глобальних геохімічних подій в історії Землі Історія Землі в світлі геохімічних даних
- •10.Динаміка геохімічного резервуару(див.Лекція 15)
- •11.Дифузія в геохімічних системах. Закони дифузії. Залежність дифузії від температури.(див. Лекція 13)
- •12.За рисунком опишіть геохімічний цикл води
- •13.За рисунком опишіть геохімічний цикл вуглецю
- •15.Змішування в геохімічних системах. Наведіть приклади
- •2 Питання
- •1.Основні закономірності поширення хімічних елементів в земній речовині і поняття кларку(див.Лекція 2)
- •2.Основні рушійні сили геохімічних процесів Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
- •3.Охарактеризуйте геохімічні процеси, пов’язані із поверхнею мінералів. Які параметри на них впливають?(лекція 8)
- •Сорбційні позиції сполуки та адсорбційні комплекси Подвійний електричний шар на границі мінерал-електроліт
- •4.Охарактеризуйте основні принципи та закони, що описують поведінку геохімічної системи в рівноважних та нерівноважних умовах.(лекція 3)
- •Теплоємність
4.Геохімічна класифікація елементів Геохімічні класифікації елементів
В гірській породі, природних водних розчинах та атмосфері хімічнм аналізом можна зафіксувати присутність 85 хімічних елементів. Ще п’ять – Rn, Ra, Ac, Po, Ne можуть бути зафіксовані як продукти радіактивного розпаду U та Th в їхніх рудах.
Геохімічна класифікація хімічних елементів, запропонована В.М. Гольдшмідтом в 1933 році . Згідно пропозиції Гольдшміта, основний поділ хімічних елементів робиться за їх асоціативністю із континентальними породами (літофільність), із багатими залізом породами (сидерофільність), можливістю формувати сульфіди (халькофільність), нагромадженням в атмосфері або у низькотемпературних водних розчинах (морська, річкова вода, підземні води) – атмофільність і гідрофільність.
Атоми літофільних (від грецького lithos - камінь) елементів концентруються в оксидних і силікатних фазах і мають в іонізованому вигляді будову аналогічну атомам інертних газів. Халькофільні (від грецького chalkos - мідь) елементи, утворюють сполуки із сіркою та її аналогами (Se, Te, As) належать до елементів побічних груп Періодичної системи із заповненою 18-атомною оболонкою, що передує валентній оболонці. Сидерофіли (від грец. sideros - залізо) – перехідні метали із незаповненою d-оболонкю, утворюють металічну фазу метеоритів і мабуть земне ядро.
Атмофільні (від грец. atmos -повітря) – інертні гази і азот, що утворює саму міцну із двоатомних молекул N2.
Додатково Вернадський запропонував виділяти циклічні елементи, що відіграють важливу роль у поверхневих геохімічних циклах, благородні (не схильні до формування хімічних сполук в природі) та радіоактивні елементи.
Геохімічна класифікація Гольдшміта, Вернадського, Беуса
Літофільні
циклічні Be, B, Na, K, Si, Al, Ti, Mg, Ca, Cr, Mn, Sr, Zr, Ba, P, W
розсіяні Li, Br, Rb, Nb, Cs, Ta,
сильно радіоактивні U, Th, Ra, Ac, Pa
рідкісноземельні TR(REE)
Сидерофільні:
циклічні Fe, Co, Ni, Mo, P
благородні Pt, Rh, Ru, Ir, Re, Os
Халькофільні
циклічні S, Cu, Ag, Pb, Zn, Pb, Sb, S, Se, Te, Hg
благородні Au, Pd
розсіяні In
Атмофільні
циклічні C, O, N, H
інертні гази He-Kr
сильно радіоактивні Rn
Гідрофільні O, H, Cl, Br, I, S
|
Рис. 3.4. Періодична система і геохімічна класифікація хімічних елементів: 1 - атмофільні, 2 - літофільні, 3 - халькофільні, 4 – сидерофільні. |
5.Геохімія радіоактивних ізотопів в системах Rb-Sr та Sm-Nd(див. Лекція 12)
6.Гідратизація поверхні мінералу та точка нульового заряду Коефіцієнт активностіповерхні та гідратизація поверхні
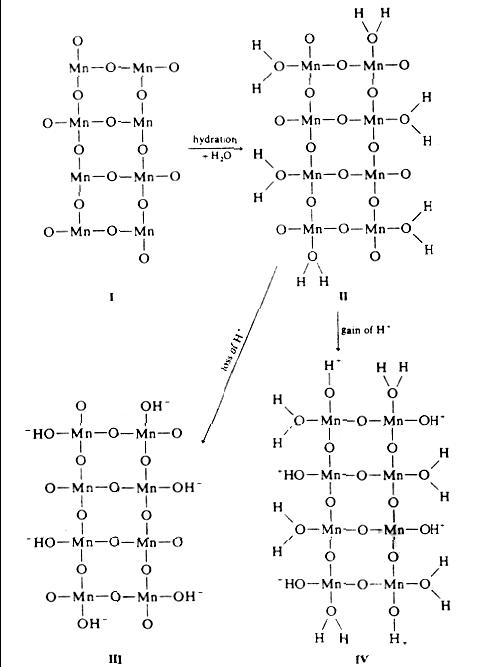
Для того, щоб зрозуміти механізм сорбційних процесів, необхідно детальніше розглянути процеси, що відбуваються на поверхні мінералу в розчині (рис. 4.1). Приєднання молекул води до поверхні компенсує поверхневий заряд, тобто поверхневий заряд зникає. Цей механізм реалізується у чистих мінералах або ж у твердих розчинах із ізовалентним ізоморфізмом. У випадку гетеровалентного ізоморфізму, поверхня буде після гідратизації частково зберігати заряд – позитивний у випадку Me+→Me2+ і негативний при протилежно спрямованому ізоморфізмі Me3+→Me2+. Такий заряд, що залишається після гідратизації поверхні, називається постійним поверхневим зарядом, п. Так звичне заміщення Si→Al в силікатів спричинює постійний негативний поверхневий заряд, як показано на рис. 3А.
Поверхневий заряд змінюється, якщо поверхневі катіони, перш за все це стосується лужних та лужно-земельних металів в кристалічній структурі мінералу, переходять в розчин. Втрата цих катіонів спричинює негативний катіон-дефіцитний поверхневий заряд, к. Після вилуговування поверхні, аніони починають доповнювати свою координацію і взаємодіяти із компонентами розчину, перш за все із H+ і OH-, активність яких в розчині є функцією pH. Такий поверхневий заряд називають координаційним і позначають як кр. Загальний заряд на поверхні мінералу 0 (заряд на см2) тоді дорівнює
0=п+к+кр.
Негативний
поверхневий заряд
Нейтральна
поверхня
Позитивний
поверхневий заряд |
|
Гідратація
поверхні
Протонування
поверхні
Депротонування
поверхні |
Рис. 4. Протонування поверхні мінералу. Зверху – загальна схема, що ілюструє зміну заряду поверхні в процесі протонування. Внизу - гідратизація та протонуванняповерхні піролюзиту MnO2
Як видно із рис. 4, сумарний заряд поверхі формується із різно-заряджених позицій OH. Для кожного із мінералів характерна поступова зміна сумарного позитивного поверхневого заряду на негативний із зростанням рН. Відповідно, існує значення pH, при якому сумарний (мережний) заряд поверхні стане нульовим. Це значення називається точкою нульового заряду ТНЗ (ізоелектричною точкою). |
7-8.Дайте характеристику варіацій δ13C в геохімічних системах.Дайте характеристику варіацій δ34S в геохімічних системах
Ізотопний обмін між мінералами, мінералами та компонентами розчину
|
|
D/H фракціонування між H2O – H2,H2O – H2S і H2O – CH4 (дані Richet et al. 1977) |
Фракціонування ізотопів карбону між сполуками (мінералами) і CO2 (за Chacko et al. 2001) |
|
|
Криві ізотопного фракціонування для системи мінерал-вода як функція температури. Символами показано експериментальні дані. За O’Neil (1986). |
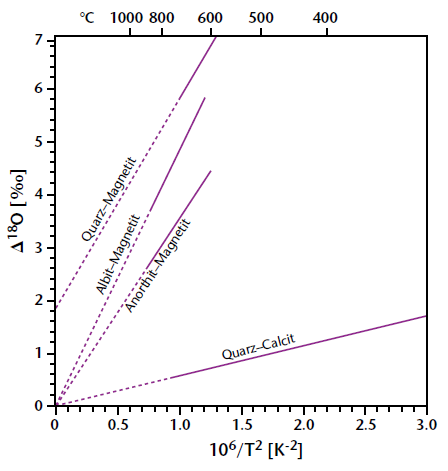
Фракціонування 18O/16O в системі мінерал-вода. За Longinelli and Nutti (1973); Labeyrie (1974). |
|
|
Фракціонування 18O/16O в системі мінерал-вода. |
Рівноважне ізотопне фракціонування для сполук сульфуру стосовно H2S (solid lines experimentally determined, dashed lines extrapolated or theoretically calculated (after Ohmoto and Rye, 1979) |
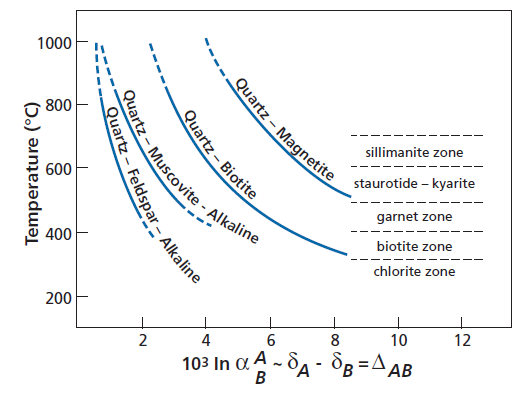
Ізотопні геотермометри

|
|
Рівноважне ізотопне фракціонування для пар оксиген-містячих мінералів залжно від тмператури |
Залежність фактора фракціонування δ34S між сульфідами: пірит-сфалерит, сфалерит-галеніт, пірит-галеніт |
|
|
Ізотопна температура визначена для порід різних фацій метаморфізму для пар мінералів. За Garlick and Epstein (1967). |
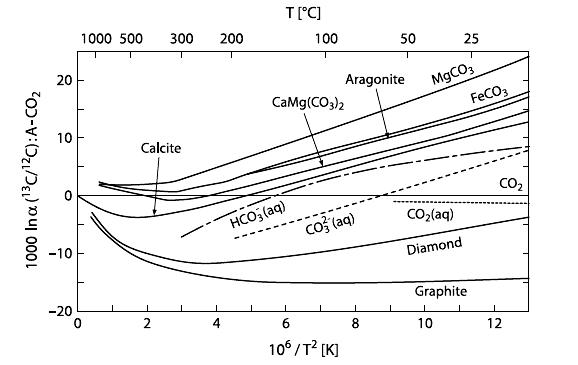
Рівноважне ізотопне фракціонування оксигену між різними мінералами і кальцитом. (after Chacko et al. 2001) |
Карбонатний палеотермометр
В 1947- 1951 р. Harold Urey ( лауреат Нобелівської премії 1934 за відкриття дейтерію) із колегами Bigeleisen і Mayer розробили теоретичні і експериментальні передумови використання фракціонування 18O між іоном CO32- і водою H2O для розрахунку температури водного розчину, із якого кристалізується кальцит
![]()
|
|
Залежність ізотопного складу кисню карбонатів від температури дозволяє визначати коливання температури в морських басейнах в минулому |
|
|
Дослідження рострів юрських белемнітів. (a) Перетин ростра белемніта. (S, літо; W, зима; Число шарів відліковується від краю). (b) Значення δ13C and температура, розрахована за значеннями δ18O. The curve shows that the belemnite was born in the fall and died in spring! After Urey et al. (1951).
Варіації δ18O для двох проб форамініфер: зверху пелагічний вид (поверхня океану), знизу – бентосний (океанічне дно) Modified after Duplessy et al. (1970). |
|
Кліматичні записи δD у льодяному керні із льодовика коло станції Восток в Антарктиді в порівнянні із δ18O записаними в донних океанічних карбонатних відкладах. Посередині крива зміни температури за карбонатним ізотопним термометром (From Jouzel, et al., 1987). |







 ’
’