- •І рівень
- •6.За рисунком опишіть геохімічний цикл води.
- •14.Наведіть приклади буферів кислотності в геохімічних системах.
- •17.Наведіть приклади геохімічних кислотно-основних буферів.
- •19.Наведіть приклади геохімічних систем із конвективними потоками речовини.
- •20.Наведіть приклади гідратаційних комплексів. Гідратація іонів у водному розчині –
- •22.Наведіть приклади кислот і основ у геохімічних процесах
- •23.Наведіть приклади метастабільних фаз
- •І рівень Питання Друге
- •6.Що таке ефект висолювання?
- •І рівень Питання Третє
- •5.Що таке іонний обмін? Іонний обмін в адсорбційних системах
- •6.Що таке кислотно-основні взаємодії?
- •7.Що таке кінетичний поріг процесу
- •9.Що таке коефіцієнт активності розчинних компонентів?
- •12.Що таке консервативні і неконсервативні іони?
- •16.Що таке механізм реакції?
- •18.Що таке носій хімічного елементу? Приклади
- •21.Що таке окисник і відновник? Приклади
- •22.Що таке окисно-відновні взаємодії
- •Іі рівень
- •1 Питання
- •4.Геохімічна класифікація елементів Геохімічні класифікації елементів
- •Геохімічна класифікація Гольдшміта, Вернадського, Беуса
- •5.Геохімія радіоактивних ізотопів в системах Rb-Sr та Sm-Nd(див. Лекція 12)
- •6.Гідратизація поверхні мінералу та точка нульового заряду Коефіцієнт активностіповерхні та гідратизація поверхні
- •9.Дайте характеристику основних глобальних геохімічних подій в історії Землі Історія Землі в світлі геохімічних даних
- •10.Динаміка геохімічного резервуару(див.Лекція 15)
- •11.Дифузія в геохімічних системах. Закони дифузії. Залежність дифузії від температури.(див. Лекція 13)
- •12.За рисунком опишіть геохімічний цикл води
- •13.За рисунком опишіть геохімічний цикл вуглецю
- •15.Змішування в геохімічних системах. Наведіть приклади
- •2 Питання
- •1.Основні закономірності поширення хімічних елементів в земній речовині і поняття кларку(див.Лекція 2)
- •2.Основні рушійні сили геохімічних процесів Основні рушійні сили геохімічних процесів
- •Принцип мінімізації вільної енергії – в стані рівноваги досягається мінімальна вільна енергія, можлива в цій системі. Люба мінеральна система прагне максимально зменшити свою вільну енергію.
- •3.Охарактеризуйте геохімічні процеси, пов’язані із поверхнею мінералів. Які параметри на них впливають?(лекція 8)
- •Сорбційні позиції сполуки та адсорбційні комплекси Подвійний електричний шар на границі мінерал-електроліт
- •4.Охарактеризуйте основні принципи та закони, що описують поведінку геохімічної системи в рівноважних та нерівноважних умовах.(лекція 3)
- •Теплоємність
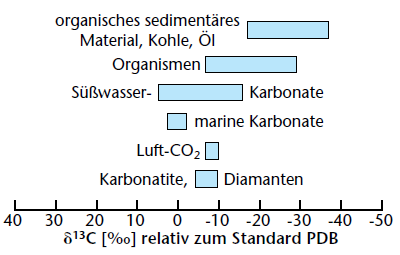
13.За рисунком опишіть геохімічний цикл вуглецю
|
Змінаδ34S H2S стосовно флюїду як функція pH і ƒO2 при 250°C. Показані поля стабільності піриту(Py), піротину(Po), магнетиту(M) та гематиту(H). За Ohmoto and Rye (1979). |
|
|
Рис. Ізотопний склад карбору у земних резервуарах
|
|
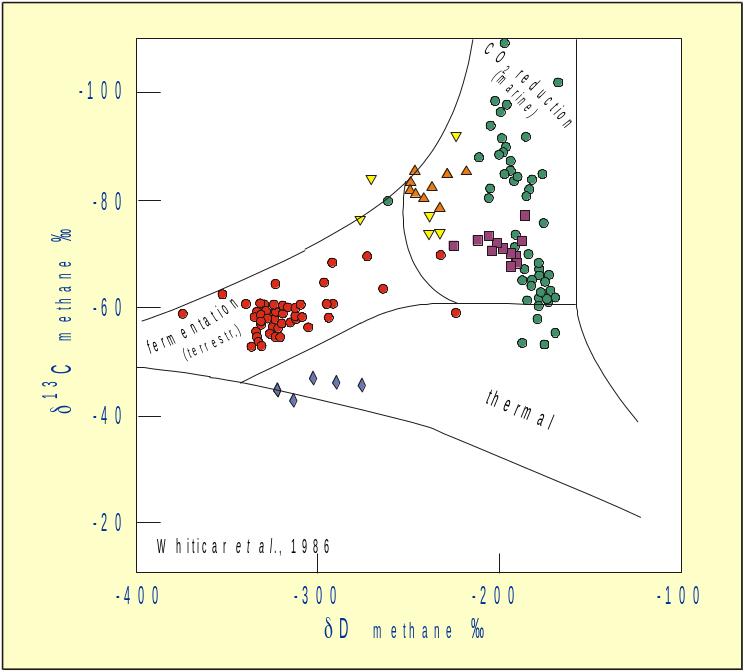
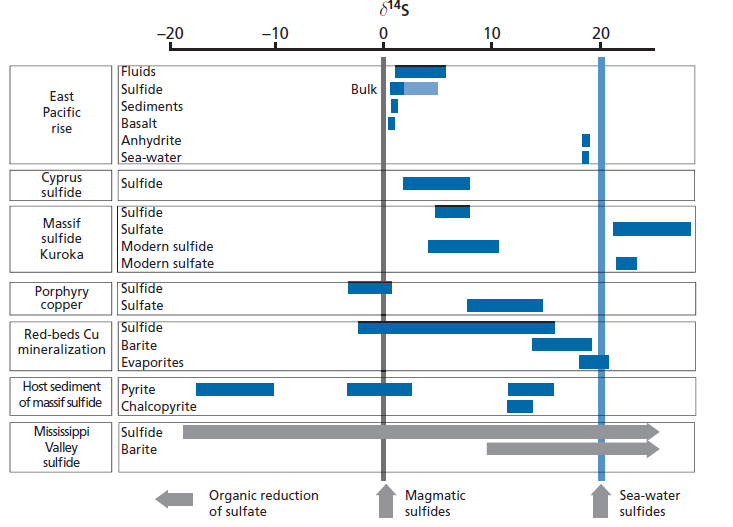
14.За рисунком опишіть геохімічний цикл сірки
|
|
Рис. 14. Варіації 34S/32S в головних земних резервуарах Notice that the domains are very extensive for all reservoirs. This corresponds to highly variable reducing conditions to which sulfur is subjected.
|
Рис. 15. Розподіл ізотопів сірки в головних сульфідних та сульфатних родовищах
|
Що стосується сірки, то максимальні фактори фракціонування характеризують процеси окиснення та відновлення –сульфат-редукцію та окиснення сульфідної сірки
15.Змішування в геохімічних системах. Наведіть приклади
Д ва
основних типи геохімічних процесів –
процеси диференціації і процеси
змішування
ва
основних типи геохімічних процесів –
процеси диференціації і процеси
змішування
Приклад процесів диференціації:
глобальна диференціація Землі
часткове плавлення мантійного матеріалу і формування океанічної кори
переробка океанічної кори в зоні субдукції + плавлення мантії = формування континентальної кори (поєднання диференціації і змішування)
Приклади змішування:
процеси формування ґрунту
процеси на місці впадіння ріки в море
Процеси звітрювання – це поєднання
диференціації і змішування. Змішування
порід і водних розчинів призводить до
руйнування граніту і формування
кварц-глинистого осаду, що співіснує
із водним розчином, в якому знаходяться
всі хімічні елементи, властиві граніту.
Всі компоненти граніту перерозподіляються
між кварцом, глинистими мінералами і
водним розчином. Якщо ми приймемо що
водний розчин до взаємодії не містив
елементів, що входять у склад граніту,
тоді можна сказати, що знаючи концентрацію
елемента i в кожному із новоутворених
мінералів та в розчині (![]() )
та частку мінералів та розчину в складі
системи fj, можна розрахувати
початкову концентрацію компонента i
)
та частку мінералів та розчину в складі
системи fj, можна розрахувати
початкову концентрацію компонента i
![]() в граніті. Кількість хімічного елементу
в такій системі не збільшується і не
зменшується, вона тільки перерозподіляється
між фазами системи. Це і є принцип
збереження маси в геохімічній системі.
в граніті. Кількість хімічного елементу
в такій системі не збільшується і не
зменшується, вона тільки перерозподіляється
між фазами системи. Це і є принцип
збереження маси в геохімічній системі.
2 Питання
1.Основні закономірності поширення хімічних елементів в земній речовині і поняття кларку(див.Лекція 2)
2.Основні рушійні сили геохімічних процесів Основні рушійні сили геохімічних процесів
Основні рушійні сили геохімічних процесів - сили або явища, що виводять систему із рівноваги:
зміна вільної енергії системи (через зміну Т, Р, хімічного потенціалу)
наявність градієнтів параметрів
зміна впорядкованості (змішування і т.п.)
Після виведення із рівноваги в системі відбуваються процеси, направлені на досягнення рівноваги.
Принципи, якими керується система на шляху до рівноваги