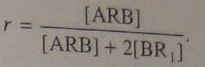- •1. Высокомолекулярные соединения: основные понятия и определения.
- •1. Первичные:
- •2. Вторичные:
- •2. Количественные характеристики длины полимерных молекул.
- •3. Свойства высокомолекулярных соединений, обусловленные цепным строением макромолекул.
- •Высокая вязкость растворов полимеров
- •4) Классификация вмс
- •5) Основные этапы развития полимерной науки и производства. Производство полимеров в Беларуси.
- •6) Структура полимерной цепи. Регулярные и нерегулярные полимеры. Уровни конфигурации макромолекулы.
- •7. Уровни иерархии конформации макромолекулы.
- •Сегмент макромолекулы. Определение понятия. Факторы, определяющие длину статистического сегмента. Методы определения длины статистического сегмента. Жесткоцепные и гибкоцепные вмс.
- •Агрегатные, фазовые и релаксационные состояния полимеров.
- •Релаксационные состояния аморфных вмс. Анализ термомеханической кривой аморфного линейного вмс.
- •13. Высокоэластическое состояние вмс.
- •14. Стеклообразное состояние вмс
- •15. Вязкотекучее состояние вмс
- •Радикальная сополимеризация. Уравнение состава сополимера. Схема Алфея-Прайса (q-e).
- •Кинетика радикальной полимеризации при малых степенях превращения.
- •Мономеры и элементарные реакции радикальной полимеризации.
- •1. Инициирование.
- •2. Рост цепи.
- •3. Обрыв цепи.
- •4. Реакции передачи цепи.
- •19)Цепные процессы образования вмс
- •20) Кинетика поликонденсации
- •21)Особенности синтеза полимеров методом поликонденсации.
- •1. Линейная поликонденсация
- •1 Поликонденсация в расплаве.
- •2 Поликонденсация в растворе.
- •3 Межфазная поликонденсация
- •Полимераналогичные превращения целлюлозы.
- •Реакционная способность мономеров и радикалов в радикальной полимеризации. Гель-эффект.
- •25. Классификация и гидродинамические свойства полиэлектролитов.
- •26. Деструкция и деполимеризация макромолекул. Принципы стабилизации высокомолекулярных соединений.
- •27.Прививочная сополимеризация
- •28. Классификация реакций сшивания макромолекул и особенности сшитых вмс.
- •29) Полимераналогичные превращения полиэтилена.
- •30).Классификация реакций вмс.
- •31) Надмолекулярные, конформационные и конфигурационные эффекты в реакциях вмс
- •32) Способы проведения полимеризации
- •33) Анионная полимеризация
- •34. Кинетика катионной полимеризации
- •35. Катионная полимеризация.
- •36. Необходимые и достаточные условия кристаллизации вмс. Основные структурные элементы Кристаллических вмс.
- •37. Способы ориентации и свойства ориентированных вмс.
- •38. Термодинамические понятия, используемые в теории растворов полимеров.
- •39. Особенности термодинамики полимерных растворов. Энергетика растворения полимеров. Набухание полимеров. Фазовые диаграммы систем полимер-растворитель.
- •40) Вязкость растворов полимеров. Определение молекулярной массы и среднеквадратичного расстояния между концами цепи методом вискозиметрии.
- •Характеристика и применение полимерных материалов: пластомеры, эластомеры, волокна, пленки, клеи.
- •1. Полиэтилен:
- •2 Изотактический полипропилен
- •3) Поливиниловый спирт
- •4) Метилметакрилат.
- •5 Фенолформальдегидные олигомеры
- •6 Полимеры и сополимеры акрилонитрила
- •7 Бутадиен
- •8 Полиизопрен
- •9 Хлоропрен
- •10 Полиэтилентерефталат (пэт)
- •11 Поликапролактам
- •12 Белки
- •13 Полиимиды
- •14 Полиуретан
- •15 Целлюлоза и ее производные
- •16 Полистирол
- •17 Полисилоксан
- •18 Поливинилхлорид
20) Кинетика поликонденсации
Рассмотрим основные кинетические закономерности поликонденсации на примере полиэтерификации. Катализаторами реакции этерификации являются кислоты и щелочи. Механизм:
Протонирование кислоты-реагента кислотой-катализатором (НА):
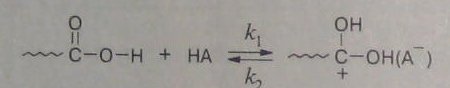
Атаки протонированным реагентом гидроксильной группы спирта с последующим распадом интермедиата до продуктов реакции:
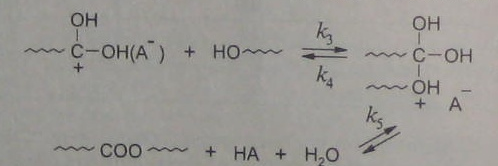
Если в данной реакции удалять воду, то можно учитывать лишь прямое направление реакции. Тогда:
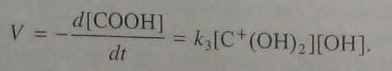 (5.96)
(5.96)
Неопределяемая величина [С+(0Н)2] может быть исключена с помощью выражения (5.97):
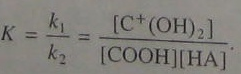
В результате получаем:
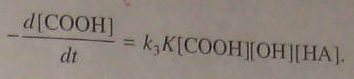 (5.98)
(5.98)
В отсутствии внешнего катализатора его функции кислота-мономер. Тогда:
![]() (5.99)
(5.99)
Где К’=к3К. тк при поликонденсации концентрации разных функциональных групп обычно равны (в целях получения ВМС полимера), то уравнение (5.99) упрощается:
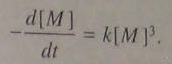 (5.100)
интегрируем:
(5.100)
интегрируем:
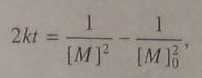 (5.101)
(5.101)
Используем
понятие степени завершенности реакции:
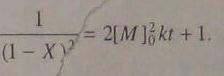 (5.102)
(5.102)
Уравнение (5.102), исходящее из третьего порядка скорости по концентрации мономера, достаточно хорошо описывает экспериментальные данные. Встречающиеся отклоняя при средних и глубоких степенях завершенности связаны с изменением состояния реакционной среды - уменьшением полярности, вследствие исчерпания карбоксильных и гидроксильных (или других полярных) групп мономеров, и возрастанием вязкости.
Степень ступенчатой полимеризации равна числу мономерных звеньев в цепи. При ступенчатой полимеризации двух нефункциональных мономеров A-R-A и B-R-B степень полимеризации равна половине их количества в цепи. Сочетание (5.92) и (5.102) приводит к зависимости степени полимеризации от времени:
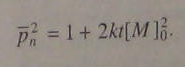
Из этого уравнения следует, что темп нарастания молекулярной массы продукта поликонденсации уменьшается со временем.
Изложенное выше касалось самокатализируемой поликонденсации. При наличии внешнего катализатора, уравнение скорости отвечает второму порядку по концентрации мономера:
![]() (5.104)
(5.104)
Интегрируем и получаем следующие уравнения с использование (5.92) и (5.106)
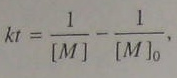 (5.105)
(5.105)
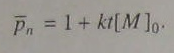 (5.106)
(5.106)
Из уравнения (5.106) следует, что при катализируемой поликонденсации имеет место линейная зависимость степени полимеризации от времени.
На практике самокатализируемая реакция используется при получении полиамидов, тогда как при получении полиэфиров и фенопластов - продуктов поликонденсации фенола с формальдегидом - применяется катализатор. При предыдущем изложении предполагалось равенство концентраций мономеров, что является одним из условий получения высокомолекулярного полимера при поликонденсации. Количественной мерой, отражающей степень эквивалентности концентраций мономеров, является параметр
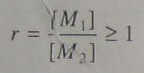 (5.107)
(5.107)
вследствие
[М1]>[М2].
Связь среднечисловой степени полимеризации
с параметром эквивалентности дается
выражением:
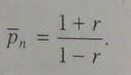 (5.108)
(5.108)
При строго эквивалентных количествах функциональных групп на концах макромолекул реакция между ними может продолжаться сколь угодно долго, теоретически - вплоть до образования гигантской макромолекулы. Из этого следует, что для стабилизации молекулярной массы полимера небольшой избыток одного из мономеров может оказаться полезным. В этом случае все макромолекулы будут иметь одинаковые функциональные группы, например А--А, что исключает возможность реакции между ними. Для этих целей используют также малые добавки монофункционального соединения. При этом уравнение (5.108) по-прежнему применимо, однако параметр r рассчитывается по-другому. При поликонденсации двух гомофункциональных мономеров ARA и BR1B в присутствии монофункционального соединения R2B
![]() (5.109)
(5.109)
где [ARA] = [BR1B]. Коэффициент 2 вводится потому, что эффект добавки R2B аналогичен эффекту избытка бифункционального мономера BR1B, a уравнение (5.109) получено применительно к реакции двух бифункциональных мономеров. При поликонденсации одного гетерофункционального мономера ARB в присутствии BR1