
- •3 Билет.
- •5 Билет
- •6 Билет
- •7 Билет.
- •8 Билет
- •9 Билет.
- •10 Билет.
- •11 Билет.
- •12 Билет
- •13 Билет
- •19 Билет
- •20 Билет
- •21 Билет
- •22 Билет
- •23 Билет
- •24 Билет.
- •Свойства веществ в различных физических состояниях
- •Типы кристаллических решёток
- •25 Билет.
- •10.4.1. Материалы, получаемые на основе полимеров
- •10.4.2. Области применения полимеров
12 Билет
Атом состоит из ядра и окружающего его электронного "облака". Находящиеся в электронном облаке электроны несут отрицательный электрический заряд. Протоны, входящие в состав ядра, несут положительный заряд. В любом атоме число протонов в ядре в точности равно числу электронов в электронном облаке, поэтому атом в целом – нейтральная частица, не несущая заряда.
СТРОЕНИЕ ЯДРА АТОМА
В
1932г. после открытия протона и нейтрона
учеными Д.Д. Иваненко (СССР) и В. Гейзенберг
(Германия) была выдвинута протонно-нейтронная
модель ядра атома.
 Согласно
этой модели:
- ядра всех
химических элементов состоят из
нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное
обозначение ядра атома
химического элемента:
Согласно
этой модели:
- ядра всех
химических элементов состоят из
нуклонов:
протонов и нейтронов
- заряд ядра
обусловлен только протонами
- число
протонов в ядре равно порядковому номеру
элемента
- число нейтронов равно
разности между массовым числом и числом
протонов (N=A-Z)
Условное
обозначение ядра атома
химического элемента:
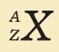 X
– символ химического элемента
А
– массовое
число,
которое показывает :
- массу ядра
в целых атомных единицах массы
(а.е.м.)
(1а.е.м. = 1/12 массы атома
углерода)
- число нуклонов в ядре
-
(A = N + Z) , где N – число нейтронов в
ядре атома
Z – зарядовое
число,
которое показывает:
- заряд ядра в
элементарных электрических зарядах
(э.э.з.)
( 1э.э.з. = заряду электрона = 1,6
х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса
ядра всегда
меньше суммы
масс покоя свободных протонов и нейтронов,
его составляющих.
Это объясняется
тем, что протоны и нейтроны в ядре очень
сильно притягиваются друг к другу. Чтобы
разъединить их требуется затратить
большую работу. Поэтому полная энергия
покоя ядра не равна энергии покоя
составляющих его частиц. Она меньше на
величину работы по преодолению ядерных
сил притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом
масс.
X
– символ химического элемента
А
– массовое
число,
которое показывает :
- массу ядра
в целых атомных единицах массы
(а.е.м.)
(1а.е.м. = 1/12 массы атома
углерода)
- число нуклонов в ядре
-
(A = N + Z) , где N – число нейтронов в
ядре атома
Z – зарядовое
число,
которое показывает:
- заряд ядра в
элементарных электрических зарядах
(э.э.з.)
( 1э.э.з. = заряду электрона = 1,6
х 10 -19 Кл)
- число протонов
- число
электронов в атоме
- порядковый номер
в таблице Менделеева
Масса
ядра всегда
меньше суммы
масс покоя свободных протонов и нейтронов,
его составляющих.
Это объясняется
тем, что протоны и нейтроны в ядре очень
сильно притягиваются друг к другу. Чтобы
разъединить их требуется затратить
большую работу. Поэтому полная энергия
покоя ядра не равна энергии покоя
составляющих его частиц. Она меньше на
величину работы по преодолению ядерных
сил притяжения.
Разность между массой
ядра и суммой масс протонов и нейтронов
называется дефектом
масс.
Изото́пы (от др.-греч. ισος — «равный», «одинаковый», и τόπος — «место») — разновидности атомов (и ядер) какого-либо химического элемента, которые имеют одинаковый атомный номер, но при этом разные массовые числа. Название связано с тем, что все изотопы одного атома помещаются в одно и то же место (в одну клетку) таблицы Менделеева. (примеры: О2 и О3)
Изоба́ры (в ед.ч. изоба́р; др.-греч. ἴσος (isos) — «одинаковый» + βάρος (baros) — «вес») — нуклиды разных элементов, имеющие одинаковое массовое число; например, изобарами являются 40Ar, 40K, 40Ca. Хотя массовое число (т. е. число нуклонов) A = N + Z в ядрах-изобарах одинаково, числа протонов Z и нейтронов N различаются.
13 Билет
Химическая
энергия, таким образом, связанa с энергией
электронов. Чтобы понимать процессы
образования и разрушения химических
соединений, следует иметь представления
о свойствах электрона вообще и особенно
о свойствах и поведении электрона в
атоме.
Электрон —
это элементарная частица, обладающая
элементарным отрицательным электрическим
зарядом, т. е. наименьшим могущим
существовать количеством электричества.
Заряд электрона равен ![]() эл.
ст. ед. или
эл.
ст. ед. или ![]() кулона.
Масса покоя электрона равна
кулона.
Масса покоя электрона равна ![]() г,
т.е. в 1837,14 раза меньше массы атома
водорода. Масса электрона
составляет
г,
т.е. в 1837,14 раза меньше массы атома
водорода. Масса электрона
составляет ![]() углеродной
единицы.Характеристика
электрона четырьмя квантовыми числами.
углеродной
единицы.Характеристика
электрона четырьмя квантовыми числами.
Основная характеристика, определяющая движение электрона в поле ядра,— это его энергия. Энергия электрона, как и энергия частицы светового потока — фотона, принимает не любые, а лишь определенные дискретные, прерывные или, как говорят, квантующиеся значения. Движущийся электрон обладает тремя степенями свободы перемещения в пространстве (соответственно трем координатным осям) и одной дополнительной степенью свободы, обусловленной наличием у электрона собственного механического и магнитного моментов, которые учитывают вращение электрона вокруг своей оси. Следовательно, для полной энергетической характеристики состояния электрона в атоме необходимо и достаточно иметь четыре параметра. Эти параметры получили название квантовых чисел. Квантовые числа, так же как и энергия электрона, могут приникать не все, а лишь определенные значения. Соседние значения квантовых чисел различаются на единицу.
Главное
квантовое число n
характеризует общий запас энергии
электрона или его энергетический
уровень. Главное квантовое число может
принимать значения целых чисел от 1
до ![]() .
Для электрона, находящегося в поле ядра
главное квантовое число может принимать
значения от 1 до 7 (соответственно номеру
периода в периодической системе, в
котором находится элемент). Энергетические
уровни обозначаются или цифрами в
соответствии со значениями главного
квантового числа, или буквами:
.
Для электрона, находящегося в поле ядра
главное квантовое число может принимать
значения от 1 до 7 (соответственно номеру
периода в периодической системе, в
котором находится элемент). Энергетические
уровни обозначаются или цифрами в
соответствии со значениями главного
квантового числа, или буквами:
п |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
Обозначение уровня |
K |
L |
M |
N |
O |
P |
Q |
Если, например, n=4, то электрон, находится на четвертом, считая от ядра атома, энергетическом уровне, или на N уровне.
Орбитальное квантовое числа l, которое иногда называют побочным квантовым числом, характеризует различное энергетическое состояние электрона данного уровня. Тонкая структура спектральных линий говорит о том, что электроны каждого энергетического уровня группируются в подуровни. Орбитальное квантовое число связано с моментом количества движения электрона при его движении относительно ядра атома. Орбитальное квантовое число определяет также форму электронного облака Квантовое число l может принимать все целочисленные значения от 0 до (п-1). Например, при n=4, l=0, 1, 2, 3. Каждому значению l соответствует определенный подуровень. Для подуровней применяются буквенные обозначения. Так, при l=0, 1, 2, 3 электроны находятся соответственно на s-, p-, d-, f- подуровнях. Электроны различных подуровней соответственно называют s-, p-, d-, f - электронами. Возможное число подуровней для каждого энергетического уровня равно номеру этого уровня, но не превышает четырех. Первый энергетический уровень (п=1) состоит из одного s-подуровня, второй (п=2), третий (п=3) и четвертый (п=4) энергетические уровни состоят соответственно из двух (s, p), трех (s, p, d) и четырех (s, p, d, f) подуровней. Больше четырех подуровней не может быть, так как значения l=0, 1, 2, 3 описываю электроны атомов всех 104 известных сейчас элементов. Если l=0 (s-электроны), то момент количества движения электрона относительно ядра атома равен нулю. Это может быть только когда электрон поступательно движется не вокруг ядра, а от ядра к периферии и обратно. Электронное облако s-электрона имеет форму шара.
Магнитное квантовое число - c моментом количества движения электрона связан и его магнитный момент. Магнитное квантовое число характеризует магнитный момент электрона. магнитное квантовое число характеризует магнитный момент электрона и указывает на ориентацию электронного облака относительного избранного направления или относительно направления магнитного поля. Магнитное квантовое число может принимать любые целые положительные и отрицательные значения, включая и ноль в пределах от – l до + l. Например, если l=2, то имеет 2 l+1=5 значений (-2, -1, 0, +1, +2). При l=3 число значений равно 2 l+1=7 (-3, -2, -1, 0, +1, +2, +3). Число значений магнитного квантового числа , которое равно 2 l+1, - это число энергетических состояний, в которых могут находиться электроны данного подуровня. Таким образом, s-электроны имеют лишь одно состояние (2 l+1=1), p-электроны – 3 состояния (2 l+1=3), d-, f-электроны – соответственно 5 и 7 состояний. Энергетические состояния принято обозначать схематически энергетическими ячейками, изображая их в виде прямоугольников, а электроны в виде стрелок в этих ячейках.
Спиновое квантовое число - характеризует внутреннее движение электрона — спин. Оно связано с собственным магнитным моментом электрона, обусловленным его движением вокруг своей оси. Это квантовое число может принимать только два значения: + 1/2 и —1/2, в зависимости от того, параллельно или антипараллельно магнитному полю, обусловленному движением электрона вокруг ядра, ориентируется магнитное поле спина электрона. Два электрона (пара) с одинаковыми значениями квантовых чисел: n, I, , но с противоположно направленными спинами (↑ ↓) называются спаренными или неподеленной парой электронов. Электроны с ненасыщенными спинами (↑↑) называются неспаренными.
Билет №14
Многоэлектронный атом представляет динамическую систему электронов движущихся в центральном поле ядра. Для ответа на вопрос, какие атомные орбитали и в какой последовательности будут заполняться электронами в его основном состоянии, следует руководствоваться следующими принципами. Принцип минимума энергии: электрон в первую очередь занимает ту из орбиталей, энергия которой является наименьшей. В соответствии принципом наименьшей энергии в атоме происходит распределение электронов по энергетическим уровням, а в рамках одного и того же уровня по подуровням. Принцип (запрет) Паули: в атоме не может быть двух электронов, находящихся в одинаковых состояниях, т.е. имеющих одинаковые значения всех четырех квантовых чисел. В соответствии с принципом Паули электроны, находящиеся на одних и тех же атомных орбиталях и, следовательно, имеющие одинаковые значения трёх квантовых чисел ( n, l и ml ), обязательно должны отличаться величинами спина (ms = ± ½ ). Правило запрета ограничивает число мест для электронов на данном энергетическом уровне, поскольку, на одной орбитали могут находиться только 2 электрона. В противном случае все электроны заняли бы орбиталь с наименьшей энергией.
Принцип Паули, являющийся одним из наиболее важных законов квантовой механики, относится ко всем элементарным частицам, имеющим полуцелый спин. Правило Хунда (Гунда): наиболее устойчивому состоянию атома соответствует состояние с максимально возможным числом не спаренных электронов на вырожденных орбиталях. Правило Хунда определяет порядок заполнения орбиталей одного подуровня (с одинаковыми значениями и n и l ), в пределах которого электроны заполняют максимальное число орбиталей. При таком размещении суммарный спин электронов в данном подуровне и в атоме в целом будет максимально возможным. Распределение электронов в атоме по энергетическим уровням осуществляется в соответствии с принципом наименьшей энергии. В первую очередь заполняются орбитали того уровня, энергия которого меньше. Из приведенных данных следует, что энергия электрона на данной орбитали в основном определяется значениями главного ( n ) и побочного ( l ) квантовых чисел. Поэтому энергетическим уровням с меньшей энергией соответствуют меньшие значения суммы (n + l). Вследствие этого заполнение орбиталей электронами осуществляется в порядке увеличения суммы главного и побочного квантовых чисел (n + l). Эту закономерность называют первым правилом Клечковского. Если орбитали имеют равные величины сумм (n + l), то порядок заполнения подчиняется втоорому правилу Клечковского, которое гласит: при одинаковых значениях сумм (n + l) сначала заполняется орбиталь с меньшим значением главного квантового числа.
В атоме водорода электрон находится в силовом поле, которое создается только ядром. В многоэлектронных атомах на каждый электрон действует не только ядро, но и все остальные электроны. При этом электронные облака отдельных электронов как бы сливаются в одно общее многоэлектронное облако.
Билет 15
Искусственная радиоактивность - радиоактивность искусственно создаваемая в устойчивых химических элементах путем их облучения потоками нейтронов в ядерных реакторах или бомбардировки этих элементов тяжелыми частицами — протонами, альфа-частицами и др.
Вследствие огромного разнообразия свойств (вид излучения, энергия-, время жизни, масса испускаемых частиц и др.) радиоактивные вещества, получаемые искусственным путем, применяют значительно шире, чем естественные (см. Изотопы). В связи с открытием искусственной радиоактивности оказалось возможным осуществить мечту средневековых алхимиков — превращать атомы одних химических элементов в атомы других элементов (см. Радиоактивность).
Вслед за этим открытием ученые в различных странах стали подвергать бомбардировке ядерными частицами буквально все химические элементы таблицы Менделеева. При этом выяснилось, что почти все они могут образовывать новые искусственные радиоактивные изотопы. В сравнительно короткий срок число таких искусственных излучателей дошло до тысячи и с каждым годом открываются все новые и новые.
Сейчас искусственные радиоактивные изотопы занимают исключительно важное место в науке и технике.
Я́дерная реа́кция — процесс образования новых ядер или частиц при столкновениях ядер или частиц. Впервые ядерную реакцию наблюдал Резерфорд в 1919 году, бомбардируя α-частицами ядра атомов азота, она была зафиксирована по появлению вторичных ионизирующих частиц, имеющих пробег в газе больше пробега α-частиц и идентифицированных как протоны. Впоследствии с помощью камеры Вильсона были получены фотографии этого процесса.
По механизму взаимодействия ядерные реакции делятся на два вида:
реакции с образованием составного ядра, это двухстадийный процесс, протекающий при не очень большой кинетической энергии сталкивающихся частиц (примерно до 10 МэВ).
прямые ядерные реакции, проходящие за ядерное время, необходимое для того, чтобы частица пересекла ядро. Главным образом такой механизм проявляется при больших энергиях бомбардирующих частиц.
Если после столкновения сохраняются исходные ядра и частицы и не рождаются новые, то реакция является упругим рассеянием в поле ядерных сил, сопровождается только перераспределением кинетической энергии и импульса частицы и ядра-мишени и называется потенциальным рассеянием.
Билет 16
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не имеет выражения в виде математического уравнения. Графическим (табличным) выражением закона является разработанная Менделеевым Периодическая система элементов.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) - классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году. Её первоначальный вариант был разработан Д. И. Менделеевым в 1869-1871 годах и устанавливал зависимость свойств элементов от их атомного веса (по-современному, от атомной массы).
Периодическая система Д. И. Менделеева стала важнейшей вехой в развитии атомно-молекулярного учения. Благодаря ей сложилось современное понятие о химическом элементе, были уточнены представления о простых веществах и соединениях.
Появление периодической системы открыло новую, подлинно научную эру в истории химии и ряде смежных наук - взамен разрозненных сведений об элементах и соединениях появилась стройная система, на основе которой стало возможным обобщать, делать выводы, предвидеть.
Главной характеристикой атома является не атомная масса, а величина положительного заряда ядра. Это более общая точная характеристика атома, а значит, и элемента. От величины положительного заряда ядра атома зависят все свойства Элемента и его положение в периодической системе. Таким образом, порядковый номер химического элемента численно совпадает с зарядом ядра его атома. Периодическая система элементов является графическим изображением периодического закона и отражает строение атомов элементов.
Теория строения атома объясняет периодическое изменение свойств элементов. Возрастание положительного заряда атомных ядер от 1-до 110 приводит к периодическому повторению у атомов элементов строения внешнего энергетического уровня. А поскольку от числа электронов на внешнем уровне в основном зависят свойства элементов; то и они периодически повторяются. В этом физический смысл периодического закона.
Билет 17
В
1913 г. английский ученый Г. Мозли, исследуя
спектры лучей Рентгена для различных
элементов, подметил закономерность,
связывающую номера элементов в
периодической системе Менделеева с
длиной волн этих лучей, получившихся в
результате облучения тех или иных
элементов катодными тучами. Оказалось,
что квадратные корни из обратных значений
длин волн этих лучей ![]() связаны
линейной зависимостью с порядковыми
номерами соответствующих элементов.
Закон Г. Мозли позволил проверить
правильность „Менделеевского ряда"
и подтвердил его безупречности.
Пусть,
например, известны значения
связаны
линейной зависимостью с порядковыми
номерами соответствующих элементов.
Закон Г. Мозли позволил проверить
правильность „Менделеевского ряда"
и подтвердил его безупречности.
Пусть,
например, известны значения ![]() для
элементов № 20 и №30, номера которых в
системе сомнений у нас не вызывают. Эти
значения связаны с указанными номерами
линейной зависимостью. Для проверки,
например, правильности номера, присвоенного
кобальту (27), и судя по атомной массе,
этот номер должен был бы иметь никель,
его облучают катодными лучами: в
результате из кобальта выделяются лучи
Рентгена. Разложением их на подходящих
дифракционных решетках (на кристаллах)
получаем спектр этих лучей и, выбрав
наиболее четкую из спектральных линий,
измеряем длину волны (
для
элементов № 20 и №30, номера которых в
системе сомнений у нас не вызывают. Эти
значения связаны с указанными номерами
линейной зависимостью. Для проверки,
например, правильности номера, присвоенного
кобальту (27), и судя по атомной массе,
этот номер должен был бы иметь никель,
его облучают катодными лучами: в
результате из кобальта выделяются лучи
Рентгена. Разложением их на подходящих
дифракционных решетках (на кристаллах)
получаем спектр этих лучей и, выбрав
наиболее четкую из спектральных линий,
измеряем длину волны (![]() )
луча, соответствующего этой линии; затем
откладываем на ординате значение
.
Из полученной точки А проводим прямую,
параллельную оси абсцисс, до пересечения
с выявленной ранее прямой. Из точки
пересечения Б опускаем перпендикуляр
на ось абсцисс: он точно укажет нам номер
кобальта, равный 27. Так, периодическая
система элементов Д. И. Менделеева - плод
логических умозаключений ученого -
получила экспериментальное подтверждение.
)
луча, соответствующего этой линии; затем
откладываем на ординате значение
.
Из полученной точки А проводим прямую,
параллельную оси абсцисс, до пересечения
с выявленной ранее прямой. Из точки
пересечения Б опускаем перпендикуляр
на ось абсцисс: он точно укажет нам номер
кобальта, равный 27. Так, периодическая
система элементов Д. И. Менделеева - плод
логических умозаключений ученого -
получила экспериментальное подтверждение.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
Современная периодическая система включает 109 химических элементов. В 1988 году был синтезирован 110 химический элемент. Из 109 химических элементов 89 обнаружены в природных объектов. Все остальные элементы синтезированы искусственно. Все элементы, которые располагаются после урана называются трансурановыми химическими элементами. Они синтезированы при помощи ядерных реакций.В периодической системе существуют горизонтальные и вертикальные ряды химических элементов.Период – это горизонтальный ряд химических элементов, расположенные в порядке возрастания заряда атомного ядра. У химических элементов находящихся в одном периоде атомы имеют одинаковое количество энергетических уровней. Всего существует семь периодов. Различают малые и большие периоды химических элементов.
Малые периоды содержат один ряд химических элементов ( первый период – два элемента второй период – восемь элементов и третий период – то же восемь химических элементов).
Большие периоды содержат по два ряда химических элементов ( Четвертый период – восемнадцать элементов пятый период – восемнадцать элементов и шестой период – тридцать два химических элемента.
Каждый период начинается со щелочного металла и заканчивается инертным газом. Изменение свойств химических элементов в пределах периода называется горизонтальной периодичностью.
Группа – вертикальные ряды, химические элементы в которых имеют одинаковое количества электронов на внешнем энергетическом уровне.
Нахождение элемента в подгруппе определяется сходством конфигурации внешнего энергетического уровня. От порядка заполнения атомных орбиталей все элементы делятся на s,p,d и f семейства.
S и P химические элементы располагаются в главных подгруппах.
D элементы располагаются в побочных подгруппах.
F элементы – это химические элементы относящиеся к семейству актиноидов и лантаноидов а также побочной подгруппы третьей группы.
Изменение свойств в пределах группы химических элементов называется вертикальной периодичностью.
Билет 18
Рассмотрим периодичность изменения свойств атомов элементов в зависимости от порядкового номера:
• радиус атомов: в периоде слева направо радиус атома уменьшается. В группе сверху вниз радиус атома увеличивается. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В подгруппах радиусы в основном увеличиваются из-за возрастания числа электронных оболочек. У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием
Энергией ионизации атома I называется количество энергии, необходимое для отрыва электрона от невозбужденного атома или иона.
Энергия ионизации I выражается в кДж∙моль–1 или эВ∙атом–1. Значение I в электронвольтах численно равно потенциалу ионизации, выраженному в вольтах, посколькуE = e-·I.
Э+ – e– = Э+, ΔH = I1 – первый потенциал ионизации; Э – e– = Э2+, ΔH = I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...
Энергия ионизации определяет характер и прочность химической связи и восстановительные свойства элементов.
Энергия ионизации изменяется периодически по мере заполнения электронами оболочек атомов. I максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I резко понижается – он минимален у щелочных металлов.
Энергия сродства к электрону. Другой важной в химии характеристикой атома является энергия сродства к электрону – энергия, выделяющаяся при присоединении электрона к нейтральному атому. Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону E значительно сложнее, чем определение энергии ионизации. Отметим, что в отличие от ионизации присоединение двух и более электронов энергетически затруднено, и многозарядные одноатомные отрицательные ионы в свободном состоянии не существуют.
Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p6 и переходные элементы. У остальных элементов в таблицеМенделеева окислительная способность нейтральных атомов повышается слева направо и снизу вверх.
В периодах электроотрицательность растет, а в группах уменьшается с ростом Z, то есть растет от Cs к F по диагонали периодической системы. Это обстоятельство до некоторой степени определяет диагональное сходство элементов.
• электроотрицательность: наиболее электроотрицательные элементы находятся в правом верхнем углу периодической системы.
Значение периодического закона и периодической системы состоит не только в том, что они завершили важнейший этап в развитии химии, но и в том, что они явились и являются поныне исходным пунктом для новых открытий и изысканий.
