
- •3 Билет.
- •5 Билет
- •6 Билет
- •7 Билет.
- •8 Билет
- •9 Билет.
- •10 Билет.
- •11 Билет.
- •12 Билет
- •13 Билет
- •19 Билет
- •20 Билет
- •21 Билет
- •22 Билет
- •23 Билет
- •24 Билет.
- •Свойства веществ в различных физических состояниях
- •Типы кристаллических решёток
- •25 Билет.
- •10.4.1. Материалы, получаемые на основе полимеров
- •10.4.2. Области применения полимеров
8 Билет
Атомная масса-это значение массы атома, выраженное в атомных единицах массы. В настоящее время атомная единица массы принята равной 1/12 массы нейтрального атома наиболее распространённого изотопа углерода 12C, поэтому атомная масса этого изотопа по определению равна совершенно точно 12. Разность между атомным весом изотопа и его массовым числом называется избытком массы. Он может быть как положительным, так и отрицательным; причина его возникновения — нелинейная зависимость энергии связи ядер от числа протонов и нейтронов, а также различие в массах протона и нейтрона. Молекулярная масса - это единица количества вещества в химии.
Относительной молекулярной массой (сокращенно - молекулярной массой) вещества называют отношение массы его молекулы к 1/12 части массы изотопа углерода 12С. Поскольку масса любой молекулы равна сумме масс составляющих ее атомов, то относительная молекулярная масса равна сумме соответствующих относительных атомных масс. Моль — количество вещества, содержащее столько реальных или условных частиц, сколько атомов содержится в 0,012 кг углерода – 12.
Определение молекулярных масс газов и паров:
Определение молекулярной массы по относительной атомной массе другого газа
D=M1/M2
Определение по молярному объему
M=p*Vm
По уравнению Менделеева-Клайперона:
PV=m*RT/M
9 Билет.
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (fЭ). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы.
Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть.
Газообразные
вещества помимо молярной массы эквивалента
имеют молярный
объем эквивалента (![]() или VЭ) –
объем, занимаемый молярной массой
эквивалента или объем одного моль
эквивалента.Размерность «л/моль». При
н.у. получаем:
или VЭ) –
объем, занимаемый молярной массой
эквивалента или объем одного моль
эквивалента.Размерность «л/моль». При
н.у. получаем:
|
Закон эквивалентов был открыт в 1792 г. И. Рихтером. Современная формулировка закона: вещества реагируют и образуются согласно их эквивалентам. Все вещества в уравнении реакции связаны законом эквивалентов, поэтому:
nэ(реагента1) = … = nэ(реагентаn) = nэ(продукта1) = … = nэ(продуктаn) |
Из закона эквивалентов следует, что массы (или объемы) реагирующих и образующихся веществ пропорциональны молярным массам (молярным объемам) их эквивалентов. Для любых двух веществ, связанных законом эквивалентов, можно записать:
|
где m1 и m2 – массы реагентов и (или) продуктов реакции, г;
![]() ,
, ![]() –
молярные массы эквивалентов реагентов
и (или) продуктов реакции,
г/моль;
–
молярные массы эквивалентов реагентов
и (или) продуктов реакции,
г/моль;
V1, V2 – объемы реагентов и (или) продуктов реакции, л;
![]() ,
,![]() –
молярные объемы эквивалентов реагентов
и (или) продуктов реакции,
л/моль.
–
молярные объемы эквивалентов реагентов
и (или) продуктов реакции,
л/моль.

 или
или 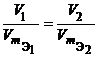 или
или 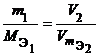 ,
,