- •3 Билет.
- •5 Билет
- •6 Билет
- •7 Билет.
- •8 Билет
- •9 Билет.
- •10 Билет.
- •11 Билет.
- •12 Билет
- •13 Билет
- •19 Билет
- •20 Билет
- •21 Билет
- •22 Билет
- •23 Билет
- •24 Билет.
- •Свойства веществ в различных физических состояниях
- •Типы кристаллических решёток
- •25 Билет.
- •10.4.1. Материалы, получаемые на основе полимеров
- •10.4.2. Области применения полимеров
24 Билет.
Характерные особенности веществ в различных агрегатных состояниях
Вещества могут находиться в трех физических состояниях: газообразном, жидком и твердом. При очень высоких температурах возможно особое состояние сильно разряженных газообразных веществ – плазма.
Газообразные вещества имеют, в основном, молекулярную структуру. Молекулы находятся друг от друга на значительном расстоянии, взаимодействие между ними практически отсутствует. Движение частиц (молекул) – хаотичное, беспорядочное. Кинетическая энергия молекул газа больше потенциальной (ЕК молекул газа > ЕП).
В жидком состоянии расстояния между частицами (молекулами, ионами) соизмеримы с размерами самих частиц и значительно меньше, чем в газообразном состоянии. В структуре наблюдается некоторая временная упорядоченность частиц, которые постоянно соприкасаются друг с другом. Между частицами существуют силы межмолекулярного взаимодействия. Частицы подвижны относительно друг друга, поэтому жидкости обладают текучестью. Кинетическая энергия частиц жидкости соответствует потенциальной (ЕК частиц в жидкости ≈ ЕП).
В твердом состоянии частицы (атомы, молекулы, ионы) сближены друг с другом на min допустимые расстояния. Между частицами действуют прочные связи различного типа. Частицы находятся в колебательном движении. Кинетическая энергия частиц твердого вещества меньше потенциальной (ЕК частиц в твердом веществе < ЕП).
Соответственно свойства веществ в различных физических состояниях существенно различаются (табл. 3).
Таблица 3
Свойства веществ в различных физических состояниях
Свойство |
Физическое состояние |
||
газообразное |
жидкое |
твердое |
|
1. Объем
2. Зависимость объема от температуры и давления 3. Форма
4. Сжимаемость
5. Текучесть
6. Диффузия 7. Плотность |
Совпадает с объемом сосуда Высокая
Принимает форму сосуда Очень высокая
Очень высокая
Быстрая Низкая |
Совпадает с объемом сосуда Малая
Принимает форму сосуда Незначительная
Высокая
Медленная От средней до большой |
Фиксированный
Очень малая
Фиксированная
Практически отсутствует При обычных температурах отсутствует Очень медленная Большая |
|
|
|
|
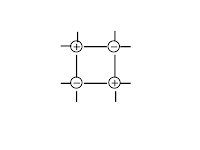
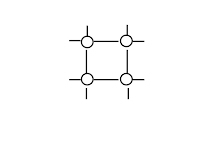
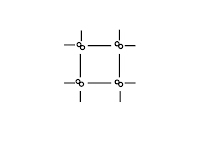
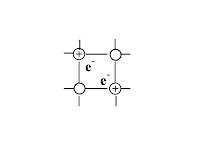
Типы кристаллических решёток
|
ионная |
атомная |
молекулярная |
металлическая |
Что в узлах кристаллической решётки, структурная единица |
ионы
|
атомы
|
молекулы
|
атомы и катионы
|
Тип химической связи между частицами узла |
ионная |
ковалентная: полярная и неполярная |
ковалентная: полярная и неполярная |
металлическая |
Силы взаимодействия между частицами кристалла |
электростати- ческие |
ковалентные |
межмолекуляр- ные |
электростати- ческие |
Физические свойства, обусловленные кристаллической решёткой |
силы притяжения между ионами велики, Тпл.↑ (тугоплавкте), легко растворяются в воде, расплав и р-р проводит эл.ток, нелетучи (не имеют запаха)
|
ковалентные связи между атомами велики, Тпл. и Tкип очень↑, в воде не растворяются, расплав не проводит эл.ток
|
силы притяжения между молекулами невелики, Тпл.↓, некоторые растворяются в воде, обладают запахом – летучи
|
силы взаимодействия велики, Тпл.↑, Высокие тепло и электропроводность
|
Агрегатное состояние вещества при обычных условиях |
твёрдое |
твёрдое |
твёрдое, газообразное, жидкое |
твёрдое, жидкое(Нg) |
Примеры |
большинство солей, щелочей, оксиды типичных металлов |
С (алмаз, графит), Si, Ge, B,SiO2, CaC2, SiC (карборунд), BN, Fe3C,TaC(tпл.=38000С) Красный и чёрный фосфор. Оксиды некоторых металлов. |
все газы, жидкости, большинство неметаллов: инертные газы, галогены, H2,N2, O2, O3, P4 (белый), S8. Водородные соединения неметаллов, оксиды неметаллов: H2O, CO2 «сухой лёд». Большинство органических соединений. |
Металл |