
- •§1 Енергія та її види. Предмет та метод технічної термодинаміки
- •§2 Термодинамічна система
- •§3 Термодинамічні параметри робочого тіла і термодинамічний стан
- •Лекція 2. . (стор.12-19)
- •§4 Термодинамічна рівновага
- •§5 Загальні властивості термодинамічних параметрів стану
- •§6 Основні параметри стану
- •§7 Рівняння стану ідеального газу
- •§8 Рівняння стану сумішей ідеальних газів (стор. 19-27)(самостійно)
- •§9 Теплоємність
- •1 Кмоль – μс - мольна..
- •§10 Внутрішня енергія (стор. 28-31)
- •§11 Форми енергообміну термодинамічної системи. Теплота і робота
- •§13 Повна енергія робочого тіла або ентальпія (стор. 47-49)
- •Лекція 4. .
- •§14 Вільна та зв’язана енергія. Поняття ентропії (стор. 50-54)
- •15. Термодинамічний процес. Оборотний і необоротний термодинамічні процеси (стор. 54-59)
- •Лекція 5.
- •§17. Перший закон термодинаміки (стор. 59-72)
- •§18. Другий закон термодинаміки (стор. 77-92)
- •Лекція 6.
- •§19. Термодинамічні потенціали та їх диференціальні рівняння (стор. 59-77)
- •§20. Обчислення ентропії
- •Тема 2 Дослідження енергетичної ефективності термодинамічних процесів ідеальних газів (стор. 106-143)
- •§1 Характеристики термодинамічного процесу
- •Лекція 7.
- •2. Ізотермічний процес.
- •3. Ізобарний процес
- •4. Ізохорний процес
- •5. Адіабатний процес
- •§6. Політропний процес
- •Тема 3 Механізм отримання роботи
- •Лекція 8. 8.10..
- •Тема 4 Водяна пара як реальний газ
- •§1 Рівняння стану реального газу (стор. 155-160)
- •§2 Загальні властивості реальних газів (стор. 160-161)
- •§3 Водяна пара. Основні визначення (стор. 162-166)
- •Лекція 9. 15.10..
- •§4 Процес пароутворення. Pv-діаграма водяної пари (стор. 166-169)
- •§6 Параметри стану води та водяної пари
- •§7 Параметри вологої насиченої пари
- •§8 Основні термодинамічні процеси водяної пари (стор. 182-188)
- •Тема 6 Вологе повітря
- •Лекція 11. 23.10.. Вологе повітря(продовження)
- •§2 Характеристики вологого повітря
- •Тема 7 Термодинаміка потоку газів і пари (відкрита термодинамічна система)
- •§1 Рівняння першого закону термодинаміки для відкритих систем (стор. 198-206)
- •§2 Основні закономірності протікання газу і пари в коротких каналах змінного перерізу (стор. 206-211)
- •Лекція 13. 29.10..
- •§3 Визначення маси при протіканні робочого тіла через сопло. Критичні характеристики потоку. Рівняння нерозривності потоку
- •§4 Вибір форми сопла. Розрахунок комбінованого сопла
- •§5 Дроселювання газів і пари
- •§6 Дроселювання водяної пари
- •Загальні термодинамічні властивості кругових термодинамічних процесів або циклів
- •§1 Класифікація і загальна характеристика термодинамічних циклів (стор. 230-242)
- •§2 Прямий оборотний цикл Карно (1824р.)(стор. 242-246)
- •§3 Зворотний оборотний цикл Карно
- •§4 Теореми Карно (стор. 248-250)
- •Тема 9 Термодинамічні потенціали та ексергія (стор. 258-271)
- •Лекція 16. 13.11.
- •Лекція 17. 20.11.. Економічна ефективність перетворення енергії
- •Тема 10 Стиснення (нагнітання робочих тіл) (стор. 272-283) Ідеальний поршневий одноступінчатий компресор
- •Багатоступінчате стиснення
- •Тема 11 Цикли двигунів внутрішнього згоряння (двз)
- •§1 Класифікація циклів двз
- •§2 Цикл двз з ізохорним підведенням теплоти (цикл Отто,1877р.)
- •Лекція №18 Теоретичний цикл Отто
- •§3 Цикл двз з підведенням теплоти під час сталого об’єму і сталого тиску. Цикл Тринклера (1904р)
- •Лекція 19. .
- •Тема 12 Цикл газотурбінної установки (гту)
- •Тема 13 Цикли паросилових установок (псу)
- •§1 Цикл Карно для водяної пари
- •Л.18.29 11*§2 Схема та робочий процес паросилової установки – цикл Ренкіна (стор. 320-329)
- •Лекція 20. 11.12.. Термічний ккд циклу Ренкіна
- •*§3 Вплив на термічний ккд циклу Ренкіна параметрів пари
- •Лекція 21. 18.12..
- •§4 Теплофікаційний цикл псу (стор. 338-341)схема
- •*§5 Узагальнений (регенеративний) цикл Карно (стор. 250-252)
- •*§7 Середньоінтегральна температура (стор. 252)
- •§8 Еквівалентний цикл Карно (стор. 253-254)
- •§9 Еталонний цикл Карно (стор.254)
- •*§10 Регенеративний цикл паросилової установки (стор. 332-337)
- •Тема 14 Парогазові цикли
- •Лекція 22. 25.12..
- •Тема 15 *Установки, що працюють за зворотними циклами (стор. 348-359)
- •§1 Загальна характеристика холодильних установок
- •§2 Цикл парової компресійної холодильної установки (стор. 354-357)
- •§3 Цикл теплового насоса (стор. 362-364)
Лекція 7.
2. Ізотермічний процес.
Дати визначення процесу.
Ізотермічним називають процес, який протікає під час постійної температури.
Записати рівняння процесу в pv- і Ts-координатах.
pv=RT, T=const
pv=const
Треба зобразити цей процес у pv- і Ts-діаграмах.
У pv-діаграмі ізотермічний процес зоб-ражується як рівнобока гіпербола.
1-2 – процес розширення.
2-1 – процес стиснення.
У Ts-діаграмі це горизонтальна пряма.

Треба записати співвідношення параметрів.
![]()
Відношення тисків зворотньопропорці-йне відомим об’ємам.
Треба визначити зміну внутріш-ньої енергії в процесі.
![]()
![]() ,
бо
,
бо
![]() .
.
Визначають зміну ентальпії у про-цесі.
![]()
![]()
Визначають зміну ентропії у про-цесі.
![]()
Так як , то:
![]() .
.
Знайти теплоту процесу.
З Ts–діаграми бачимо, що:
q=площа (1-2-3-4);
![]() .
.
Знайдемо роботу цього процесу.
;
pv=RT;
![]() ;
;
 ;
;
 ;
;
![]() ;
;
; ;
![]() .
.
Зображуємо схему енергобалансу процесу.
Згідно з I законом термодинаміки:

Визначаємо коефіцієнт викорис-тання термодинамічного потенціалу в про-цесі (КВП).

У точці 2 термодинамічний потенціал (вільна енергія) рівний нулю:
![]() ;
;
![]() .
.
Якщо в ізотермічному процесі до робо-чого тіла підвести меншу кількість теплоти q`< площі (1-2-3-4), тоді процес закінчиться у точці 2`. Тобто, не буде використаний весь термодинамічній потенціал f, що приведе до зменшення потужності двигуна.

Знаходимо коефіцієнт перетворе-ння енергії в процесі (КПЕ).
![]()
Це є відношення енергії направленого руху, яка отримана в процесі, до енергії ха-отичного руху, яка приймала участь у цьо-му процесі.
![]()
3. Ізобарний процес
Ізобарним називають процес, який протікає при сталому тиску.
Рівняння ізобарного процесу у pv-діаграмі:
Р=const
У Ts-діаграмі
![]() ;
;
![]() ;
;
![]() .
.
Зобразимо цей процес в pv–діаг-рамі та Ts–діаграмі:

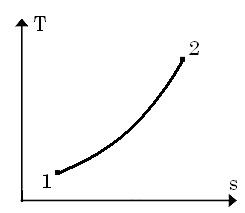
У Ts-діаграмі це логарифмічна крива.
Співвідношення параметрів ста-ну.
![]() поділимо
на
поділимо
на
![]() .
.
Отримаємо:
![]() .
.
.
.
 .
.Теплота процесу:
![]() .
.
; P=const;
 .
.Схема енергобалансу

КВП:
![]() ,
де
,
де
![]() – вільна ентальпія.
– вільна ентальпія.
КПЕ:
![]() .
.
4. Ізохорний процес
Ізохорним називають процес, який протікає при сталому об’ємі.
Рівняння ізохорного процесу в pv-діаграмі: v=const.
У Ts–діаграмі:
![]() .
.
У pv-діаграмі це вертикальна пряма.

У Ts-діаграмі це логарифмічна крива.

1-2 – ізобара P=const.
1-3 – ізохора V=const.
Якщо у Ts-діаграмі через одну і ту ж то-чку проходить і ізобара, і ізохора, то ізобара йде більш полого, а ізохора – більш круто.
;
![]() ;
;
.
Написати співвідношення для па-раметрів стану.
![]() поділимо
на
поділимо
на
![]() .
.
Отримаємо:
![]() .
.
.
.
.
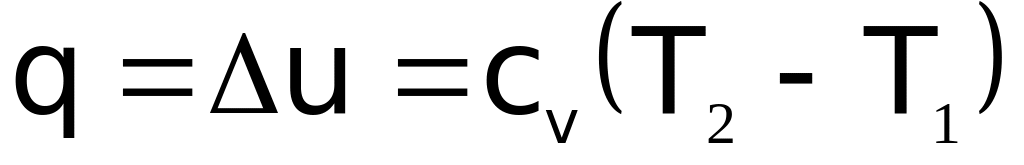 .
.;
 ;
;
 .
.
d(pv)=vdp+pdv;
pdv=0;
![]() .
.
Схема енергобалансу:
.

КВП:
![]() .
.
КПЕ:
![]() .
.
Це в тому випадку, якщо розглядати роботу розширення:
![]() .
.
5. Адіабатний процес
Адіабатним називають процес, який протікає без теплообміну з навколиш-нім середовищем.
 у
pv-діаграмі.
у
pv-діаграмі.
![]() ,
,
де k – показник адіабати.
У Ts-діаграмі:
![]() .
.
У адіабатному процесі ентропія зали-шається незмінною.
Зображення цих процесів у pv-ді-аграмі – нерівнобока гіпербола.

Якщо у pv-діаграмі через одну і ту ж то-чку проходить адіабата і ізотерма, то адіа-бата йде більш круто, а ізотерма – більш полого.
 ;
;

 .
. .
. .
. .
. ;
;
 ;
;
![]() (1)
(1)
![]() ;
;
 ;
;
![]() (2)
(2)
![]() (3)
(3)
![]() .
.
Підставимо
замість
![]()
![]() :
:
 (4)
(4)
 ;
;
 (5)
(5)
Схема енергобалансу.

