
- •§1 Енергія та її види. Предмет та метод технічної термодинаміки
- •§2 Термодинамічна система
- •§3 Термодинамічні параметри робочого тіла і термодинамічний стан
- •Лекція 2. . (стор.12-19)
- •§4 Термодинамічна рівновага
- •§5 Загальні властивості термодинамічних параметрів стану
- •§6 Основні параметри стану
- •§7 Рівняння стану ідеального газу
- •§8 Рівняння стану сумішей ідеальних газів (стор. 19-27)(самостійно)
- •§9 Теплоємність
- •1 Кмоль – μс - мольна..
- •§10 Внутрішня енергія (стор. 28-31)
- •§11 Форми енергообміну термодинамічної системи. Теплота і робота
- •§13 Повна енергія робочого тіла або ентальпія (стор. 47-49)
- •Лекція 4. .
- •§14 Вільна та зв’язана енергія. Поняття ентропії (стор. 50-54)
- •15. Термодинамічний процес. Оборотний і необоротний термодинамічні процеси (стор. 54-59)
- •Лекція 5.
- •§17. Перший закон термодинаміки (стор. 59-72)
- •§18. Другий закон термодинаміки (стор. 77-92)
- •Лекція 6.
- •§19. Термодинамічні потенціали та їх диференціальні рівняння (стор. 59-77)
- •§20. Обчислення ентропії
- •Тема 2 Дослідження енергетичної ефективності термодинамічних процесів ідеальних газів (стор. 106-143)
- •§1 Характеристики термодинамічного процесу
- •Лекція 7.
- •2. Ізотермічний процес.
- •3. Ізобарний процес
- •4. Ізохорний процес
- •5. Адіабатний процес
- •§6. Політропний процес
- •Тема 3 Механізм отримання роботи
- •Лекція 8. 8.10..
- •Тема 4 Водяна пара як реальний газ
- •§1 Рівняння стану реального газу (стор. 155-160)
- •§2 Загальні властивості реальних газів (стор. 160-161)
- •§3 Водяна пара. Основні визначення (стор. 162-166)
- •Лекція 9. 15.10..
- •§4 Процес пароутворення. Pv-діаграма водяної пари (стор. 166-169)
- •§6 Параметри стану води та водяної пари
- •§7 Параметри вологої насиченої пари
- •§8 Основні термодинамічні процеси водяної пари (стор. 182-188)
- •Тема 6 Вологе повітря
- •Лекція 11. 23.10.. Вологе повітря(продовження)
- •§2 Характеристики вологого повітря
- •Тема 7 Термодинаміка потоку газів і пари (відкрита термодинамічна система)
- •§1 Рівняння першого закону термодинаміки для відкритих систем (стор. 198-206)
- •§2 Основні закономірності протікання газу і пари в коротких каналах змінного перерізу (стор. 206-211)
- •Лекція 13. 29.10..
- •§3 Визначення маси при протіканні робочого тіла через сопло. Критичні характеристики потоку. Рівняння нерозривності потоку
- •§4 Вибір форми сопла. Розрахунок комбінованого сопла
- •§5 Дроселювання газів і пари
- •§6 Дроселювання водяної пари
- •Загальні термодинамічні властивості кругових термодинамічних процесів або циклів
- •§1 Класифікація і загальна характеристика термодинамічних циклів (стор. 230-242)
- •§2 Прямий оборотний цикл Карно (1824р.)(стор. 242-246)
- •§3 Зворотний оборотний цикл Карно
- •§4 Теореми Карно (стор. 248-250)
- •Тема 9 Термодинамічні потенціали та ексергія (стор. 258-271)
- •Лекція 16. 13.11.
- •Лекція 17. 20.11.. Економічна ефективність перетворення енергії
- •Тема 10 Стиснення (нагнітання робочих тіл) (стор. 272-283) Ідеальний поршневий одноступінчатий компресор
- •Багатоступінчате стиснення
- •Тема 11 Цикли двигунів внутрішнього згоряння (двз)
- •§1 Класифікація циклів двз
- •§2 Цикл двз з ізохорним підведенням теплоти (цикл Отто,1877р.)
- •Лекція №18 Теоретичний цикл Отто
- •§3 Цикл двз з підведенням теплоти під час сталого об’єму і сталого тиску. Цикл Тринклера (1904р)
- •Лекція 19. .
- •Тема 12 Цикл газотурбінної установки (гту)
- •Тема 13 Цикли паросилових установок (псу)
- •§1 Цикл Карно для водяної пари
- •Л.18.29 11*§2 Схема та робочий процес паросилової установки – цикл Ренкіна (стор. 320-329)
- •Лекція 20. 11.12.. Термічний ккд циклу Ренкіна
- •*§3 Вплив на термічний ккд циклу Ренкіна параметрів пари
- •Лекція 21. 18.12..
- •§4 Теплофікаційний цикл псу (стор. 338-341)схема
- •*§5 Узагальнений (регенеративний) цикл Карно (стор. 250-252)
- •*§7 Середньоінтегральна температура (стор. 252)
- •§8 Еквівалентний цикл Карно (стор. 253-254)
- •§9 Еталонний цикл Карно (стор.254)
- •*§10 Регенеративний цикл паросилової установки (стор. 332-337)
- •Тема 14 Парогазові цикли
- •Лекція 22. 25.12..
- •Тема 15 *Установки, що працюють за зворотними циклами (стор. 348-359)
- •§1 Загальна характеристика холодильних установок
- •§2 Цикл парової компресійної холодильної установки (стор. 354-357)
- •§3 Цикл теплового насоса (стор. 362-364)
§13 Повна енергія робочого тіла або ентальпія (стор. 47-49)
Розглянемо рівняння стану для 1 кг газу.
(6)
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ,Дж/кг.
,Дж/кг.
![]() – повна
енергія робочого тіла або ентальпія.
Це рівняння для m кг:
– повна
енергія робочого тіла або ентальпія.
Це рівняння для m кг:
H=U+pV
Також, як і внутрішня енергія, ентальпія є функція тільки температури.

Перетворення--conversion
Лекція 4. .
§14 Вільна та зв’язана енергія. Поняття ентропії (стор. 50-54)
Ще в 1875 році німецький вчений Ге-мгольц запропонував гіпотезу, в якій сказа-но, що внутрішня енергія U складається з двох частин:
U=F+TS (1)
F – вільна енергія, Дж.
TS – зв’язана енергія, Дж.
T- абсолютна температура, К.
S – ентропія,.Дж/К,
s – питома ентропія, .
Поняття ентропія було введено ще в 1865 році німецьким вченим Клаузіусом, який сказав, що існує функція відношення елементарної кількості теплоти δQ до абсолютної температури T, яку він позначив dS і назвав S-ентропія.
![]() ,
Дж/К,
,
Дж/К,
![]() ,
.
,
.
Це кількісна залежність, вона не має фізичного змісту.
Вільна енергія – це частина внутрішньої енергії, яка під впливом теплоти переходить у зв’язану енергію, і під час цього виконується робота.
Зв’язана енергія – це частина внутріш-ньої енергії, на яку не впливає теплота і яка під впливом теплоти не підлягає ніяким змінам.
Фізичний зміст ентропії:
Це є частина внутрішньої енергії робо-чого тіла, яка припадає на 1К його темпе-ратури і яка під впливом теплоти не пере-творюється в роботу.
![]()
Ентропія вказує на роботоздатність робочого тіла: чим більше ентропія тим менша роботоздатність робочого тіла.
H – повна енергія, ентальпія.
H=U+pV
H=F+TS+pV
F+pV=G
G – вільна ентальпія.
H=G+TS (2)
h=g+Ts ,
U – внутрішня енергія.
pV – потенціальна енергія тиску.
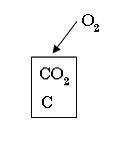
Енергетична модель робочого тіла
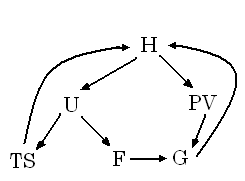
Окремі частини енергії робочого тіла взаємопов’язані. Термодинамічний стан робочого тіла змінюється під час зміни хоча б однієї з цих величин.
15. Термодинамічний процес. Оборотний і необоротний термодинамічні процеси (стор. 54-59)
Термодинамічний процес – це сукупність змін термодинамічного стану системи. Термодинамічний процес, в якому всі проміжні стани є рівноважні, називається рівноважним. Тобто, якщо візьмемо плоску систему координат, то термодинамічний процес буде відображений так:
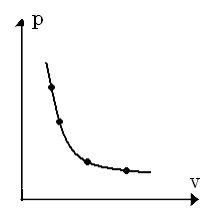
Процес, в якому хоча б один з термоди-намічних станів є нерівноважним, назива-ється нерівноважним.
Процес, при якому іде розширення ро-бочого тіла зі збільшенням його об’єму, на-зивається процесом розширення або пря-мим процесом.
Процес, в якому протікає стиснення ро-бочого тіла, називається процесом стисне-ння або зворотнім процесом.
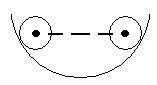
Нехай кулька рухається по впуклій по-верхні. Якщо нема тертя, то вона підніме-ться на ту ж висоту, з якої почала свій рух. Якщо є тертя, то частину енергії кулька втратить на те, щоб подолати сили тертя. Поступово її рух затихне. Оборотним на-зивається процес, в якому робоче тіло про-ходить в прямому і зворотному напрямках через одні і ті ж самі проміжні стани, і після цього повертається в початковий стан без витрати на то енергії ззовні. Необоротним називають процес, в якому робоче тіло після завершення зворотного процесу не може повернутись в початковий стан без витрати енергії ззовні. Для протікання оборотного процесу необхідно виконати такі умови:
процес повинен бути рівноважним;
нескінченно повільне протікання процесу;
відсутність втрат енергії на подо-лання тертя;
відсутність хімічних процесів, вна-слідок яких утворюються речовини з новими властивостями.
Таким чином, під час протікання необоротного процесу умовою є наявність тертя і витрата енергії на подолання дисипативних сил. Дисипативними силами називають сили, що направлені в протилежний бік у порівнянні з напрямом руху тіла і на подолання яких витрачається енергія (енергія дисипації). 16 . Грфічний метод дослідження.
Під час вивчення термодинамічних процесів широко використовується графіч-ний метод дослідження термодинамічних процесів. Для цього використовують дві си-стеми координат:
рv
р – абсолютний тиск;
v – питомий об’єм.

рv-діаграма
Особливістю цієї системи координат є те, що елементарна площа площадки є рdv, тому:

Площа, обмежена кривою процесу, кра-йніми ординатами і віссю абсцис, являє собою в деякому масштабі роботу цього процесу.
Ts
T – абсолютна температура;
s – питома ентропія.

Ts-діаграма
![]() -
кількісна залежність.
-
кількісна залежність.

У системі координат (T,s) площа,яка обмежена кривою процесу, крайніми ординатами і віссю абсцис в деякому масштабі являє собою теплоту процесу.
Недоліком цих дігарам є те, що проводиться аналіз зміни в процесі тільки двох параметрві термодинамічного стану: p, v або Т, s. Термодинамічний стан характеризують 6 параметрів стану і невідомо як у процесі змінюються одночасно всі інші параметри. Тому невідомо, як змінюється загальний взаємозв’язок між параметрами стану.
Шість парметрів стану можна записати таким чином
![]()
 pv=TR;
u=Tcv;
h=Tcp;Ts=b
pv=TR;
u=Tcv;
h=Tcp;Ts=b
Абсолютна температура Т входить до складу всіх параметрів стану і є загальною координатою. Тому можна зообразити всі шість параметрів на діаграмі з координатами Те.
Є чотири величини з однаковою розмірністю :
![]() ,
,
![]() ,
,
![]() ,
,
![]() .
.
Тому, значення всіх цих величин можна відкласти на одній вісі в системі координат, кожна з них характеризує енергію, яку позначимо, у загальному вигляді, літерою е.
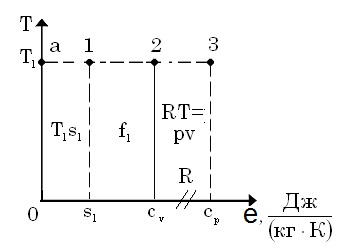
Графічне зображення енергетичної моделі робочого тіла
Площа
![]() – внутрі-шня
енергія.
Площа 0—а—1—s=Ts
= b—питома
зя-язана енергія(bound—англ.).
– внутрі-шня
енергія.
Площа 0—а—1—s=Ts
= b—питома
зя-язана енергія(bound—англ.).
Площа
![]() – питома
вільна енергія(
free—англ.).
– питома
вільна енергія(
free—англ.).
Площа
![]() – питома
ентальпія.
– питома
ентальпія.
