
- •§1 Енергія та її види. Предмет та метод технічної термодинаміки
- •§2 Термодинамічна система
- •§3 Термодинамічні параметри робочого тіла і термодинамічний стан
- •Лекція 2. . (стор.12-19)
- •§4 Термодинамічна рівновага
- •§5 Загальні властивості термодинамічних параметрів стану
- •§6 Основні параметри стану
- •§7 Рівняння стану ідеального газу
- •§8 Рівняння стану сумішей ідеальних газів (стор. 19-27)(самостійно)
- •§9 Теплоємність
- •1 Кмоль – μс - мольна..
- •§10 Внутрішня енергія (стор. 28-31)
- •§11 Форми енергообміну термодинамічної системи. Теплота і робота
- •§13 Повна енергія робочого тіла або ентальпія (стор. 47-49)
- •Лекція 4. .
- •§14 Вільна та зв’язана енергія. Поняття ентропії (стор. 50-54)
- •15. Термодинамічний процес. Оборотний і необоротний термодинамічні процеси (стор. 54-59)
- •Лекція 5.
- •§17. Перший закон термодинаміки (стор. 59-72)
- •§18. Другий закон термодинаміки (стор. 77-92)
- •Лекція 6.
- •§19. Термодинамічні потенціали та їх диференціальні рівняння (стор. 59-77)
- •§20. Обчислення ентропії
- •Тема 2 Дослідження енергетичної ефективності термодинамічних процесів ідеальних газів (стор. 106-143)
- •§1 Характеристики термодинамічного процесу
- •Лекція 7.
- •2. Ізотермічний процес.
- •3. Ізобарний процес
- •4. Ізохорний процес
- •5. Адіабатний процес
- •§6. Політропний процес
- •Тема 3 Механізм отримання роботи
- •Лекція 8. 8.10..
- •Тема 4 Водяна пара як реальний газ
- •§1 Рівняння стану реального газу (стор. 155-160)
- •§2 Загальні властивості реальних газів (стор. 160-161)
- •§3 Водяна пара. Основні визначення (стор. 162-166)
- •Лекція 9. 15.10..
- •§4 Процес пароутворення. Pv-діаграма водяної пари (стор. 166-169)
- •§6 Параметри стану води та водяної пари
- •§7 Параметри вологої насиченої пари
- •§8 Основні термодинамічні процеси водяної пари (стор. 182-188)
- •Тема 6 Вологе повітря
- •Лекція 11. 23.10.. Вологе повітря(продовження)
- •§2 Характеристики вологого повітря
- •Тема 7 Термодинаміка потоку газів і пари (відкрита термодинамічна система)
- •§1 Рівняння першого закону термодинаміки для відкритих систем (стор. 198-206)
- •§2 Основні закономірності протікання газу і пари в коротких каналах змінного перерізу (стор. 206-211)
- •Лекція 13. 29.10..
- •§3 Визначення маси при протіканні робочого тіла через сопло. Критичні характеристики потоку. Рівняння нерозривності потоку
- •§4 Вибір форми сопла. Розрахунок комбінованого сопла
- •§5 Дроселювання газів і пари
- •§6 Дроселювання водяної пари
- •Загальні термодинамічні властивості кругових термодинамічних процесів або циклів
- •§1 Класифікація і загальна характеристика термодинамічних циклів (стор. 230-242)
- •§2 Прямий оборотний цикл Карно (1824р.)(стор. 242-246)
- •§3 Зворотний оборотний цикл Карно
- •§4 Теореми Карно (стор. 248-250)
- •Тема 9 Термодинамічні потенціали та ексергія (стор. 258-271)
- •Лекція 16. 13.11.
- •Лекція 17. 20.11.. Економічна ефективність перетворення енергії
- •Тема 10 Стиснення (нагнітання робочих тіл) (стор. 272-283) Ідеальний поршневий одноступінчатий компресор
- •Багатоступінчате стиснення
- •Тема 11 Цикли двигунів внутрішнього згоряння (двз)
- •§1 Класифікація циклів двз
- •§2 Цикл двз з ізохорним підведенням теплоти (цикл Отто,1877р.)
- •Лекція №18 Теоретичний цикл Отто
- •§3 Цикл двз з підведенням теплоти під час сталого об’єму і сталого тиску. Цикл Тринклера (1904р)
- •Лекція 19. .
- •Тема 12 Цикл газотурбінної установки (гту)
- •Тема 13 Цикли паросилових установок (псу)
- •§1 Цикл Карно для водяної пари
- •Л.18.29 11*§2 Схема та робочий процес паросилової установки – цикл Ренкіна (стор. 320-329)
- •Лекція 20. 11.12.. Термічний ккд циклу Ренкіна
- •*§3 Вплив на термічний ккд циклу Ренкіна параметрів пари
- •Лекція 21. 18.12..
- •§4 Теплофікаційний цикл псу (стор. 338-341)схема
- •*§5 Узагальнений (регенеративний) цикл Карно (стор. 250-252)
- •*§7 Середньоінтегральна температура (стор. 252)
- •§8 Еквівалентний цикл Карно (стор. 253-254)
- •§9 Еталонний цикл Карно (стор.254)
- •*§10 Регенеративний цикл паросилової установки (стор. 332-337)
- •Тема 14 Парогазові цикли
- •Лекція 22. 25.12..
- •Тема 15 *Установки, що працюють за зворотними циклами (стор. 348-359)
- •§1 Загальна характеристика холодильних установок
- •§2 Цикл парової компресійної холодильної установки (стор. 354-357)
- •§3 Цикл теплового насоса (стор. 362-364)
§6 Основні параметри стану
До основних параметрів відносяться: абсолютний тиск, питомий об’єм і абсолютна температур
Тиском називають силу, з якою діє газ на одиницю поверхні посудини, в якій він знаходиться.Вимірюється в Н/м2=Па.
Питомими
називають
величини,
які віднесені до 1 кількісної одиниці
речовини, в якості якої розглядають 1
кг, 1
![]() і 1 кмоль. Всі питомі величини позначаються
малими літерами.
і 1 кмоль. Всі питомі величини позначаються
малими літерами.
На
практиці користуються величиною
![]() .
.
Несистемна
одиниця:
![]() .
.
В
технічній системі одиниць (СО) за одиницю
тиску приймають![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() .
.
![]() =
=![]()
![]() ;
;
![]()
![]() .
.
Вимір
тиску
![]()
Якщо маємо посудину з газом під тиском р, то тиск газу в посудині, виміряний в ньютонах, називається абсолютним тиском. Саме він є параметром стану.
Вимір
вакууму

Температура – це міра нагрітості тіла, або величина, яка вказує на напрям довільного переходу теплоти від більшої температури до меншої.
Т
Наприклад,
температура повітря
![]() ,
термометр зі шкалою Фаренгейта буде
показувати
,
термометр зі шкалою Фаренгейта буде
показувати
![]() -за
абсолютною шкалою Кельвіна(1848р.), система
СІ,
-за
абсолютною шкалою Кельвіна(1848р.), система
СІ,
![]() -
100-градусна шкала Цельсія, технічна
система одиниць.
-
100-градусна шкала Цельсія, технічна
система одиниць.
![]()
![]()
![]()
![]()
![]()
![]() -шкала
Фарангейта(1774р.), англійська
система.
-шкала
Фарангейта(1774р.), англійська
система.
![]()
![]() )
)
Нормальні
умови:
![]() ,
,
![]()
![]()
![]() .
.
Нормальні технічні умови:
![]() ,
,
![]() .
.
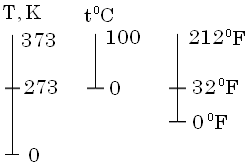
§7 Рівняння стану ідеального газу
Залежність між трьома параметрами стану називають рівнянням стану.
![]()
R
– питома газова стала,
![]() .
.
![]() (1)
рівняння
Клапейрона.
(1)
рівняння
Клапейрона.
R – це величина, яка має однакове зна-чення для всіх термодинамічних станів да-ного газу. Газова стала має такий фізичний зміст: це потенціальна енергія тиску робо-чого тіла, яка припадає на 1К його темпе-ратури.
Продиференціюємо рівняння (1):
![]() ;p=const,
;p=const,
![]() ,
,
![]() – це робота.
– це робота.
Фізичний зміст питомої газової сталої R полягає в тому, що це є робота, яку виконує 1 кілограм газу під час свого розширення в ізобарному процесі під час нагрівання на 1 кельвін.
R=pdv/T
Знайдемо значення газової сталої для нормальних умов (тиск ).
1 мм рт. ст.=133,333 Па
р=101325 Па
![]()
![]() ,
,
де
![]() –
об’єм 1 кмоля газу за нормальних умов.
–
об’єм 1 кмоля газу за нормальних умов.
![]()
![]() .
.
![]() ;
;
pvm=mRT,
m – маса робочого тіла.
vm=V;
pV=mRT (2) для m кг газу
![]() ,
,
– об‘єм 1 кмоля газу.
![]()
![]() ,
,
![]() – універсальна
газова стала
– це
величина, яка має однакове значення для
всіх газів і усіх станів.
– універсальна
газова стала
– це
величина, яка має однакове значення для
всіх газів і усіх станів.
![]() (3)
– рівняння
Клапейрона-Менделеєва для 1 кмоля газу.
(3)
– рівняння
Клапейрона-Менделеєва для 1 кмоля газу.
Якщо ми маємо n кмолей газу:
![]()
![]() (4)
– для n кмолей газу.
(4)
– для n кмолей газу.
§8 Рівняння стану сумішей ідеальних газів (стор. 19-27)(самостійно)
Гази, які знаходяться в одному об’ємі і які не вступають в хімічну реакцію, мають назву суміші газів.
Згідно з законом Дальтона, тиск суміші дорівнює сумі парціальних тисків газів, що в неї входять:
![]()
![]() +
+![]() +...+
+...+![]() ,
,
р – тиск суміші;
, ,..., – парціальний тиск компоне-нтів.
За
законом Амага об’єм суміші ідеаль-них
газів v дорівнює сумі парціальних
об’є-мів
![]() окремих компонентів:
окремих компонентів:
![]()
![]() +
+![]() +
+![]() +…+
+…+![]() =
∑
=
∑
Парціальним об’ємом компонента сумі-ші газів називається об’єм, який би займав цей компонент при тиску і температурі су-міші. Рівняння стану для кожного компо-нента:
![]() ;
;
![]() ;
;
………
![]() .
.
Тобто,
![]() .
.
Оскільки
![]() ,
то
,
то
![]() ,
,
![]() –
маса
даного компонента в суміші газів;
–
маса
даного компонента в суміші газів;
![]() –
газова
стала даного компо-нента.
–
газова
стала даного компо-нента.
![]()
![]()
Кількісне
співвідношення окремих га-зів, які
входять до суміші, може бути зада-но
масовими, об’ємними і мольними част-ками.
Масова
частка
– це
відношення ма-си
![]() компонента
до маси m газової суміші. Позначається
компонента
до маси m газової суміші. Позначається
![]() .
.
![]()
![]()
![]() +
+![]() +…+
+…+![]() =
=
![]()
Отже,
![]()
Об’ємною
часткою
називається
відно-шення парціального об’єму
компонента
до об’єму
газової суміші і позначається
![]() .
.
![]()
![]()
Оскільки
![]() ,
то
,
то
![]() ,
тому
,
тому
![]() .
.

Мольна
частка
–
це відношення числа молей даного газу
![]() до числа молей сумі-ші газів n; позначається
до числа молей сумі-ші газів n; позначається
![]() .
.
![]()
![]()
![]()
Величина
![]() називається
середньою
уя-вною молекулярною масою газової
суміші
і
дорівнює дійсній молекулярній масі
деяко-го однорідного газу, який, також
як і суміш, при однаковій загальній масі
m має одне і те ж саме число молей n.
називається
середньою
уя-вною молекулярною масою газової
суміші
і
дорівнює дійсній молекулярній масі
деяко-го однорідного газу, який, також
як і суміш, при однаковій загальній масі
m має одне і те ж саме число молей n.
![]()
Поділимо ліву і праву частину рівності на m. З отриманого рівняння виразимо .

знайдемо
залежності
![]() та
та
![]() .
.
![]()
 ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
![]() ;
;
(1)
(2)
Поділимо друге рівняння на перше:
![]() ;
;
![]() ;
;
![]() .
.
Також є справедливою формула:
 .
.
Всі наведені співвідношення справедливі для газової суміші, якщо її розглядати як ідеальний газ.
Лекція 3. (стор. 36-47)
