
- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
Донорно – акцепторный механизм ковалентной связи
NH4+ |
H3O+ |
ион аммония |
ион гидроксония |
NH3 + H+ = NH4+ |
H2O + H+= H3O+ |
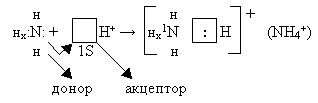
Ион водорода – атом Н, потерявший свой единственный электрон и имеющий свободную орбиталь.
H0 – e H+ |
|
На связь с водородом идет 3 электрона атома азота

Неподелённая электронная пара азота самопроизвольно, с энергетическим выигрышем, занимает свободную орбиталь иона водорода.
 .
.
Атом азота, имеющий неподелённую электронную пару, называется донором.
Частица принимающая электронную пару на свою свободную орбиталь, называется акцептором.
Отсюда - донорно – акцепторная связь.
В случае донорно – акцепторной связи две частицы соединяются в одну при помощи электронной пары (также как в ковалентной связи по методу валентных связей).
При возникновении донорно-акцепторной связи частицы не имеют неспаренных валентных электронов. В данном случае одна частица имеет неподелённую электронную пару, а другая - свободную орбиталь. Это отличает донорно- акцепторный механизм от ковалентной связи по методу валентных связей.
Понятие ковалентной связи объяснило образование, строение и свойства очень многих веществ, органических и неорганических.
4.3 Водородная связь
Атом водорода – самый маленький и самый легкий из всех существующий атомов. Имеет заряд +1. С наиболее электроотрицательными элементами (F, О, N) водород образует дополнительные связи, которые называют водородными.
Водородная связь возникает между водородом и кислородом, которые принадлежат к различным молекулам и ковалентно между собой не связаны.
Водородную связьобозначают точками.
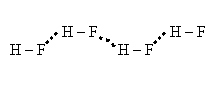
Водородная связь близка к межмолекулярным связям. Все межмолекулярные связи имеют низкую энергию.
Энергия водородной связи низкая: 8 ÷ 40 кДж/моль.
Наиболее высокая энергия водородной связи у водорода с фтором (25÷ 40 кДж/моль), ниже - с О (13÷ 29 кДж/моль) и еще ниже с N (8 ÷ 21 кДж/моль).
Водородная связь характерна для спиртов, карбоновых кислот, в том числе высших и нуклеиновых, белков, поэтому, несмотря на низкую энергию связи, водородная связь крайне важна для жизни на Земле.
Лекция 2.
Растворы. Теория электролитической диссоциации. рН растворов. Буферные системы. Гидролиз солей. Комплексные соединения. Окислительно-восстановительные реакции (ОВР).
Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов.
Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар.
В одном растворителе может находиться несколько растворенных веществ. Например, в воде растворены сахар, соль и уксусная кислота.
Количество растворенного вещества в определенном количестве раствора или растворителя, которое может колебаться в очень широких пределах, называется концентрацией раствора.
