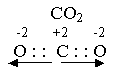- •Іщенко а.В.
- •Понятие об атомах
- •1.2. Молекулы, радикалы и ионы
- •1.3. Основные понятия и законы химии
- •2. Строение атомов
- •2.1 Электронная оболочка атома
- •2.2 Система квантовых чисел
- •2.3 Законы, определяющие положение электронов в атоме
- •4. Первый закон Клечковского
- •5. Второй закон Клечковского
- •3. Периодическая таблица Менделеева
- •3.2 Формирование больших периодов
- •3.3 Группы таблицы Менделеева
- •4. Теория химической связи
- •4.1 Ионная связь
- •4.2 Ковалентная связь
- •Донорно – акцепторный механизм ковалентной связи
- •4.3 Водородная связь
- •Способы выражения концентрации растворов
- •Применимость закона действия масс
- •Сильные и слабые электролиты
- •Степень диссоциации. Константа электролитической диссоциации
- •Химическая активность. Ионная сила раствора
- •Гидролиз солей Определения
- •Ионное произведение воды Водородный показатель
- •Три случая гидролиза солей
- •Первый случай гидролиза
- •Второй случай гидролиза
- •Третий случай гидролиза
- •Количественные характеристики гидролиза
- •Кислота является либо легколетучей, либо трудно растворимой и её константа диссоциации не превышает 10-7.
- •Основание является трудно растворимым соединением и её константа диссоциации не превышает 10-8.
- •Способы подавления гидролиза солей
- •Первый способ - регулирование рн солевого раствора
- •Понижение температуры солевого раствора ,
- •Важным свойством буферных растворов является их способность сохранять постоянное значение рН при разбавлении раствора.
- •Комплексные соединения
- •Система названий комплексных соединений
- •1. Анион внешней сферы. 2. Катион внутренней сферы:
- •1. Комплексный анион:
- •2. Катион внешней сферы.
- •Диссоциация комплексных соединений и ионов
- •Классификация комплексных соединений
- •Применение комплексных соединений
- •Окислительно - восстановителные реакции
- •Тема: основы аналитической химии.
- •Общие аналитические свойства элементов. Цель и задачи аналитической химии.
- •Правильность и точность анализа.
- •Понятие о химических и физико-химических методах анализа.
- •Группы методов анализа.
- •3. Классификация методов количественного анализа
- •4. Качественный анализ
- •Методы качественного анализа
- •«Мокрый метод»
- •4.2. Кислотно-основная классификация катионов
- •4.3. Кислотно-щелочная классификация анионов
- •5. Количественный анализ
- •5.1 Гравиметрический метод анализа
- •5.1.1. Общая характеристика метода.
- •5.1.2. Требования к осадкам
- •5.1.3. Требования к весовой форме:
- •5.1.4. Осаждающие реагенты
- •5.1.5.Расчетные формулы в гравиметрии.
- •5.1.6. Основные положения гравиметрии.
- •5.2. Титриметрический метод анализа.
- •5.2.1. Общая характеристика метода.
- •5.2.2. Требования к реакциям в титриметрическом методе.
- •5.2.3. Определение точки эквивалентности.
- •По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
- •По веществу-свидетелю
- •Классификация методов титриметрического анализа.
- •5.2.5. Способы титрования.
- •5.2.6. Расчеты в титриметрическом анализе.
- •5.2.7. Основные положения титриметрического метода.
- •2. Реакции спиртов с галогеноводородами (sn) (см. Получение галогенугдеводородов)
- •3. Образование простых эфиров
- •4. Образование сложных эфиров (этерификация)
- •5. Окислительно-восстановительные реакции
4. Теория химической связи
Атомы являются простыми частицами, не существующими самостоятельно.
Атомы объединяются в более сложные частицы:
молекулы(С3, Н8, О3),
радикалы (С2Н5-),
ионы (NН4+).
Те силы и механизмы, которые заставляют атомы объединяться в сложные частицы, называют химической связью. От типа химической связи зависит основные свойства вещества.
Электропроводность:
Сu |
NaCl |
C12H22O11 |
в любом виде проводит ток |
в жидком виде проводит ток |
не проводит ток |
4.1 Ионная связь
Ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион.
Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na0
–
![]() =
Na+
(катион)
Cl0
+
=
Cl--
(анион)
=
Na+
(катион)
Cl0
+
=
Cl--
(анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:
KF; CaCl2; NaI.
Ионная связь имеет два основных свойства:
ненаправленность,
ненасыщаемость.
Эти два свойства тесно связанны между собой.
Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака.
В этом заключается ненасыщаемость.
Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность.
Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи.
В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием.
В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы:
AB=A++B-.
Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:
AmBn .
4.2 Ковалентная связь
Ковалентная связь является наиболее универсальной в том плане, что ей подчиняется подавляющее большинство веществ как органических, так и неорганических.
Суть ковалентной связи по методу валентных связей (ВС) заключается в том, что атомы, объединяя свои неспаренные валентные электроны с антипараллельными спинами в общую электронную пару, образуют более сложную частицу.
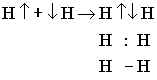 .
.
Электронную пару по методу ВС обозначают двумя точками или чёрточкой - валентным штрихом.
Ковалентная связь имеет пять основных свойств:
1. Энергия связи – выделенная атомами потенциальная энергия при образовании ими более сложных частиц.
При сближении двух атомов водорода максимально выделяется 435 кДж/моль. Это и является энергией молекулы водорода. Такой энергии соответствует максимально прочная молекула водорода. Энергия ковалентной связи лежит в пределах 150 ÷ 1000 кДж/моль. Чем выше энергия, тем прочнее частица.
![]() =
150 кДж/моль
=
150 кДж/моль
![]() =
435 кДж/моль
=
435 кДж/моль
![]() =
970 кДж/моль.
=
970 кДж/моль.
2. Длина связи – расстояние между центрами двух атомов, которое соответствует максимально потерянной потенциальной энергии, и сложная частица является наиболее прочной. Таким образом, длина связи тесно связана с энергией.
Для
атома водорода длина связи составляет
0,74
![]() .
.
![]()
Это означает, что два атома Н2 не просто соприкасаются, а частично перекрывают друг друга.

Область перекрытия показывает место нахождения общей электронной пары и называется областью повышенной электрической плотности.
3. Полярность
Ковалентные частицы могут быть полярными и неполярными. Полярная ковалентная связь возникает в том случае, если частица образованна атомами с различными электроотрицательностями.
|
+1 -1 |
HF |
|
ЭО (Н) = 2,1 |
+1 -1 |
ЭО (F) = 4 |
H : F |
В молекуле возникают два поля – диполи (+ ; -), между которыми есть какое-то расстояние. Диполь определяется дипольным моментом, который равен заряду электрона, умноженному на дипольное расстояние
μ = е • l
Размерность дипольного момента Кулон/метр (Кл/м).
Чем больше разница между электроотрицательностью элементов, тем больше дипольный момент сложной частицы, т.е. тем полярней диполь.
Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковой электроотрицательностью.
В ковалентных неполярных частицах общая электронная пара принадлежит одинаково ядрам обоих атомов.
расстояние между "+" и "–" равно нулю.
Дипольный момент тоже равен нулю.
Полярность связи и полярность частиц не всегда совпадают между собой.
|
|
|
Полярность – векторная величина. Вектор всегда направлен от менее электроотрицательных элементов к более электроотрицательным элементам.
В молекуле СО2 два вектора, равные по величине, но противоположные по направлению, компенсируют друг друга, и молекула оказывается неполярной при полярной связи.
4. Насыщаемость ковалентной связи заключается в том, что все неспаренные валентные электроны обязаны участвовать в образовании сложных частиц.
Электроны обладают способностью самопроизвольно перераспределяться по подуровням в пределах одного энергетического уровня (без изменения главного квантового числа).

Из четырёх валентных электронов неспаренными являются два и валентность углерода в данном случае равна двум.

Теперь все четыре валентных электрона распарены, и валентность углерода равна четырем
5. Направлентность ковалентной связи заключается в том, что ковалентные частицы имеют определённую пространственную конфигурацию.
Пространственная конфигурация отдельной частицы определяется количеством σ – связей и их взаимным расположением в пространстве.
σ- связями называются связи, у которых область повышенной электрической плотности располагается на линии, связывающей ядра двух атомов.
σ – связь - это первичная связь. Она является прочной и трудно разрывается.
π – связью называется та связь, при которой обе повышенные электрические плотности располагаются выше и ниже линии, связывающей ядра двух атомов.
π – связь всегда вторична и менее прочна, чем σ – связь.
При образовании молекулы водорода перекрываются 2S – облака, и образуется одна σ – связь.
Возникает линейная молекула с нулевым валентным углом.

Такие же частицы, т.е. линейные с нулевым валентным углом, образуются при перекрывании двух рх – облаков, при образовании, например, молекул хлора или фтора.
Такие же частицы образуются при перекрывании S- и p-облаков (например, HCl).
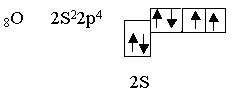
Рассмотрим элемент шестой группы таблицы Менделеева - кислород.
 .
.
Кислород является центральным атомом в молекуле воды.
Из шести валентных электронов атомов кислорода - два неспаренных. в пространстве возникают две σ–связи, расположенные друг к другу под теоретическим углом 90°.
В молекуле воды угол равен 105°, но это вызывается дополнительными причинами.
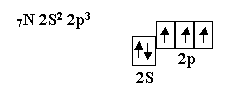
Азот, элемент пятой группы таблицы, имеет следующее валентное окончание:
 .
.
Атом азота имеет три неспаренных электрона, которые участвовуют в образовании частиц, например, NH3.
Три σ – связи, расположенные под углом 90° по отношению друг к другу, приводят к образованию молекулы, имеющей форму треугольной пирамиды с валентными углами 90°.
Углерод, элемент четвёртой группы таблицы, в возбуждённом состоянии имеет четыре неспаренных электрона и проявляет валентность, равную четырём
 .
.
Электроны, находящиеся в S- и в p-состояниях, не равноценны между собой, так как имеют разную конфигурацию и различный запас потенциальной энергии. Чтобы образовать равноценные связи, эти электроны должны гибридизироваться.